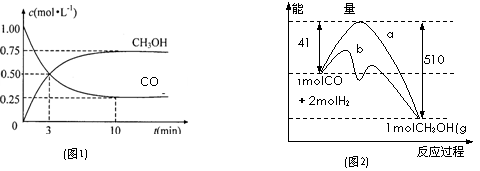
 |
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_________;
(2) 图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________(选填“吸热”或“放热”)反应,写出反应的热化学方程式____________________________;选择适宜的催化剂, ______(填“能”或“不能”)改变该反应的反应热;
(3) 该反应平衡常数K的表达式为______________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 增大的有______。
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
- 答案
一 二、选择题
题号
1
2
3
4
5
6
7
8
答案
B
A
D
B
B
A
D
D
题号
9
10
11
12
13
14
答案
D
BD
CD
C
AD
AC
15.(1)防止暴沸 冷凝回流
(2)3.2
(3)温度过高发生副反应。
(4)除去产物中的丁醇。(每空2分)
16.(1)SO2
(1分) 
 (1分) (2)第四周期第Ⅷ族(2分)
(1分) (2)第四周期第Ⅷ族(2分)
(3)2Al+Fe2O3 Al2O3+2Fe (2分) 0.1 mol (1分)
Al2O3+2Fe (2分) 0.1 mol (1分)
(4) ③(1分)
(5) 3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O(2分)
(6) Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O(2分)
2K2FeO4+3KNO2+2H2O(2分)
17.(共8分)
(1)0.075mol/L・min(1分)
(2)放热, CO(g)+2H2(g) → CH3OH(g) +91KJ, 不能(各1分,共3分)
(3)K = ,减小;(各1分,共2分) (4)c(2分)
18.
(1)反应速率突然减小(或铁片表面生成的气泡突然减少)(2分)
(2)过滤(1分)
(3)b、d(2分),Fe和Cu(1分)
(4)抑制Fe2+、NH4+水解(2分)
(5)避免加热过程中晶体受热分解(或被氧化)(2分)
19.(每空2分)
(1) 氧化还原反应 (2)
氧化还原反应 (2)
(3)C10H12O4
(4)
20.(每空2分,共10分)
(1)2.8×105 ;18
(2)86.96%
(3) ;138
;138
21.A(1)●:AlF6- ○:Na+ AlF6- 电解炼铝的助熔剂(各1分)
(2).H2O2分子间存在氢键(1分),与水分子可形成氢键(1分)。
(3)3d104s1(1分) Cr(1分) 共价键、配位键(2分)
降低Cu(NH3)4SO4・H2O的溶解度(2分)
B.(1) Fe + 2H+ → Fe2+ + H2↑;CuO + 2H+ → Cu2+ + H2O (各2分)
(2) ① (1分)
(3) ③ (1分)
(4) ①③ (2分)
(5) ②④① (2分)
(6)二; (1+3分)
(1+3分)

