1.(石景山区)(3分)甲、乙两组同学分别对一种“铜锌合金”进行了如下探究:
[提出问题]该铜锌合金中铜的质量分数是多少?
[查阅资料]⑴该合金结构紧密,所含的锌只有部分与盐酸反应;
⑵该合金能全部溶于稀硝酸,生成Cu(NO3)2和Zn(NO3)2的混合溶液。
[设计并实验]
甲组:称取7.4 g合金,放入足量的盐酸中直到反应停止,收集到0.02 g氢气。
乙组:称取7.4 g合金,放入足量的稀硝酸中,全部溶解后加入足量的铁,完全反应,得到6.66 g铜。
[数据处理]根据上述实验结果,请你帮助他们分别计算出合金中铜的质量分数。
甲组:
乙组:
[反思与评价]实验不合理的组是 ,其原因是 。
甲组:设产生0.02 g H2需要锌的质量为x。
Zn + 2HCl = ZnCl2 + H2↑
65 2
x 0.02 g
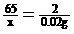
x=0.65 g
合金中铜的质量分数为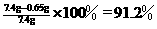 ……………………………(1分)
……………………………(1分)
乙组:合金中铜的质量分数为: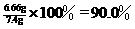 ………………………(1分)
………………………(1分)
甲 甲组实验方案中的锌未完全反应,所以测得铜的质量分数偏高………(1分)
(其他解法合理且正确均给分)
- 答案

