1.实验室配制1mol・L-1盐酸250mL,下列不需用的仪器是: ( )
A.250容量瓶 B.托盘天平 C.胶头滴管 D.烧杯
2.将4gNaOH固体溶于水配成50mL溶液,其物质的量浓度为 ( )
A.0.1mol/L B.0.5mol/L
C.1mol/L D.2mol/L
3.
A.0.1 mol・L-1 B.1 mol・L
4.将30mL 0.5mol/L NaCl溶液加水稀释到500mL,稀释后溶液中NaCl的物质量浓度为 ( )
A.0.03mol/L B.0.3mol/L C.0.05mol/L D. 0.04mol/L
5.相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+ 物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是 ( )
A.C1 =C2 B.C1 >C
6.若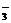 的浓度是 ( )
的浓度是 ( )
A.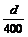 mol・L-1 B.
mol・L-1 B.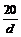 mol・L-1
mol・L-1
C.2.5d mol・L-1 D.1.25d mol・L-1
7.已知25?氨水的密度为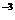 ,5?氨水的密度为
,5?氨水的密度为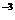 ,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
( )
,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
( )
A.等于15? B.小于15? C.大15? D.无法估算
8.在
A.小于100mL B.等于100mL C.大于100mL D.等于100/ρmL
9.在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为 ( )
A.0.15 mol/L B. 0.10 mol/L C.0.25 mol/L D. 0.20 mol/L
10.用10 mL的0.1 mol・L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是 ( )
A.3∶2∶2 B.1∶2∶
11.标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于
A.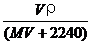 B.
B.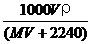
C.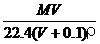 D.1000VρM/(MV+2240)
D.1000VρM/(MV+2240)
12.下列关于0.1mol/LBa(NO3)2溶液正确的说法是 ( )
A.该溶液可由
B.
C.
D.
13.下列溶液中Cl-浓度与50 mL 1 mol・L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )
A.150 mL 1 mol・L-1的NaCl溶液 B.75 mL 2 mol・L-1 NH4Cl溶液
C.150 mL 3 mol・L-1的KCl溶液 D.75 mL 1 mol・L-1的FeCl3溶液
14.配制一定物质的量浓度的KOH溶液时,造成实验结果偏低的原因是 ( )
A.容量瓶中原有少量蒸馏水 B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时观察液面俯视 D.定容时观察液面仰视
15.向25mL 2mol・L-1稀硫酸中加入25mL 1mol・L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(溶液混后体积变化忽略不计) ( )
A.2mol・L-1 B.1mol・L
16.体积为V mL、密度为ρ g/cm3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol/L,溶质的质量分数为W%,下列表示式中正确的是 ( )
A.c=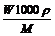 B.m=
B.m=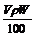
C.W%=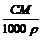 % D.c=
% D.c=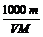
17.(7分)用
(1)若从中取出10mL,其物质的量浓度为 mol/L;含溶质质量 g。
(2)若将这10mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为 ______mol/L。若将该溶液中的SO42-全部沉淀下来,至少需要加入0.1mol/L的BaCl2溶液__________mL。
18.(6分)(1)在标准状况下,将一充满HCl气体的集气瓶倒放于盛有足量水的水槽中,充分溶解后,溶液充满集气瓶,若假设HCl全部留在集气瓶中,则集气瓶内所得溶液中HCl的物质的量浓度为_____________mol/L。
(2)在标准状况下,用将一充满HCl和氧气混合气体的集气瓶倒放于盛有足量水的水槽中,水面上升至集气瓶容积的4/5就停止了,则原集气瓶中混合气体的平均相对分子质量为_______.若假设HCl全部留在集气瓶中,则集气瓶内所得溶液HCl的物质的量浓度为_____________mol/L。
19.(4分)已知98%H2SO4溶液的物质的量浓度为18.4mol・L-1,该溶液的密度>
______________________________________________________________________
________________________________________________________________________
20.(13分)实验室用密度为
(1)配制250mL0.1mol/L的盐酸溶液
应称量盐酸体积/mL
应选用容量瓶的规格/mL
除容量瓶外还需要的其它仪器
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
A.用30mL水洗涤烧杯2―3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2―
(3)操作A中,将洗涤液都移入容量瓶,其目的是 。
溶液注入容量瓶前需恢复到室温,这是因为_______________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响?没有进行A操作 ;加蒸馏水时不慎超过了刻度 ;定容时俯视_________________________.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
21.(6分) 向某氯化钡溶液中,逐滴滴入密度为
22.(10分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol・L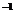 、密度为
、密度为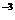 的氨水,试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的式量以17.0计,水的密度以
的氨水,试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的式量以17.0计,水的密度以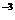 计)
计)

