1.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不吻合的是
A.用“绿色化学”工艺,使原料完全转化为产物
B.大量使用农药化肥提高粮食产量
C.推广垃圾的分类存放、回收、处理
D.推广燃煤脱硫技术,防治SO2污染
2.最近俄罗斯科学家用铪和钨两种核素精确测定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据182 72Hf(铪―182)和182 74W(钨―182)两种核素的含量比例得出的。下列有关铪―182和钨―182的关系说法正确的是
A.互为同位素 B.互为同素异形体 C.原子质量几乎相同 D.中子数相等
3.氯仿(CHCl3)可用作麻醉剂,但常因保存不慎而被空气氧化,产生光气,方程式:
2CHCl3+O2==2HCl+2COCl2(光气)
光气有剧毒。为防止事故发生,用以检验氯仿是否变质的试剂是
A.澄清石灰水 B.硝酸银溶液 C.漂白粉溶液 D.氢氧化钠溶液
4.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是
A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰
5.湿润的KI-淀粉试纸接触某气体而显蓝色,该气体中可能是
①Cl2 ②NO2 ③H2S ④SO2 ⑤HCl ⑥溴蒸气
A.①③④ B.①②⑤ C.①②⑥ D.②④⑤
6.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是
A.由2Fe + 3Cl2
 2 FeCl 3可推出同族的碘也有2Fe + 3I2(g)
2 FeCl 3可推出同族的碘也有2Fe + 3I2(g)  2 FeI3
2 FeI3
B.Fe3O4可表示为FeO・Fe2O3,则Pb3O4可表示为PbO・Pb2O3
C.Mg能在CO2中燃烧,所以Na也能在CO2中燃烧
D.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
7.某烧碱溶液中含有少量杂质纯碱,要除去此杂质需要加适量的下列试剂
A.CaCl2溶液 B.Ba(NO3)2溶液 C.Ca(OH)2溶液 D.稀盐酸
8. 某溶液中含有HCO3-、SO32-、Cl-和Na+,若其中通入Cl2,溶液中离子浓度基本保持不变的是
A.HCO3- B.SO32- C.Cl- D.Na+
9.有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法不正确的是
A.自然界硅元素的贮量丰富 B.自然界中存在大量的单质硅
C.高纯度的单质硅被广泛用于制作计算机芯片 D.硅可由二氧化硅还原制得
10.在给定的四种溶液中,各离子能在该溶液中大量共存的是
A.滴加石蕊液显红色的溶液:Fe3+、NH4+、Cl?、SCN-
B.pH为1的溶液:Cu2+、Na+、Mg2+、NO3?
C.pH为13的溶液:K+、HCO3?、Br?、Ba2+
D.所含溶质为Na2SO4的溶液:K+、AlO2?、NO3?、Al3+
11.将mg钠和铝的混和物放入ng水中,待反应停止后,过滤得到ag单质不溶物,则滤液中的溶质是
A.NaAlO2 B.NaAlO2和NaOH C.Al(OH)3 D.NaOH
12.香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水CuSO4 ②澄清石灰水 ③红热CuO
④碱石灰 ⑤品红溶液 ⑥酸性KMnO4溶液等药品可将其一一检出,检测时香烟烟雾通入药品的正确顺序是
A.①⑤②④②③②④① B.①⑤⑥⑤②④②③②
C.③④②⑥⑤①② D.②⑤①④③⑥②
13.用脱脂棉包住约0.2gNa2O2粉末,投入盛满CO2的集气瓶中,棉花燃烧,这个实验不能得出的结论是
A.该反应是一个放热反应 B.CO2在一定条件下可以支持燃烧
C.该实验的反应中有O2生成 D.Na2O2可作为呼吸面具中氧气来源
14.在一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+ ③Cl― ④NO3― ⑤S2― ⑥CO32― ⑦NH4+ ⑧Mg2+ ⑨Al3+ ⑩AlO2―离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨ C.③④⑦⑧⑨ D.①②③⑤⑥⑩
15.下列除去杂质的方法正确的是
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
16.完全溶解
A.
17.以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1mol H3O+ 中含有NA个电子
B.标准状况下,
C.
D.
18.下列各组稀溶液,不用其它试剂或试纸,仅利用溶液间的相互反应,不能将它们区别开的是
A.KNO3、Na2SO4、CaCl2、BaCl2 B.NaHSO4、MgSO4、Na2CO3、NaOH
C.HCl、BaCl2、Na2CO3、NaOH D.H2SO4、Al2(SO4)3、NaCl、NaOH
19.已知X、Y是原子核电荷数不大于18的元素。X原子的最外层电子数为a,次外层电子数为a+2;Y原子的最外层电子数为b-5,次外层电子数为b。判断X、Y两元素形成化合物组成是
A.XY2 B.Y4X C.Y2X3 D.YX3
20.硫酸铵在一定条件下发生反应:4(NH4)2SO4=== N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应生成的混合气体通入到BaCl2溶液中,将会出现的现象是
A.无沉淀生成 B.生成BaSO4沉淀
C.生成BaSO3沉淀 D.生成BaSO4和BaSO3沉淀
21.下列叙述与相应反应的离子方程式正确的是
A.少量的SO2通入到漂白粉溶液中:SO2 + Ca2+ + 2ClO― + H2O == CaSO3↓+ 2HClO
B.F2通入NaCl溶液中:F2 + 2Cl― ==
C.少量SO2通入过量的氨水中:NH3•H2O + SO2 == NH4+ + HSO3―
D.过量的CO2通入漂白粉溶液中:CO2 + ClO― + H2O == HCO3― + HClO
22. A、B、C、D都是短周期元素,原子半径:D>C >A >B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是
A. A、C两元素处在元素周期表中的第ⅥA族
B. B、D两元素组成的离子化合物中阴、阳离子的个数比为1∶1
C. B、C、D三种元素组成的化合物的化学式为DCB2
D. B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
23.将Cu 放入0.1mol・L―1 FeCl3溶液中,反应一段时间后取出Cu片,溶液中c(Fe3+):c(Fe 2+)=2:3 ,则Cu2+ 与Fe3+ 的物质的量之比为
A.3:2
B.3:
第Ⅱ卷(共54分)
24.(6分)贮气袋中贮有有色气体,可能由NO2、 CH4 、CO2、 HCl 、NH3 、Br2 (蒸气)等气体中的几种混合而成。现进行如下实验:
①通入少许水中,得无色溶液;
②通入少许AgNO3溶液中,有沉淀析出;
③通入少许澄清石灰水中,无浑浊现象;
④通过盛水的洗气瓶后,导出的气体再通入澄清的石灰水,石灰水变浑浊。
根据上述实验现象试判断:
该贮气袋中的气体一定存在 ,一定不存在 ,可能存在的是 。
25.(8分) 2NO + I2
+ 2NaI+ 2H2O
2NO + I2
+ 2NaI+ 2H2O
(1)上述反应中氧化剂是 ,若有0.75mol的还原剂被氧化,则被还原的氧化剂是 mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒。
进行实验时,必须选用的物质有 。(填序号)
(3)某厂废切削液中,含2%-5%的NaNO2,直接排放会造成污染,下列试剂 (填序号)能使NaNO2转化为不引起二次污染的N2 。
① NaCl ② NH4Cl ③ H2O2 ④ 浓H2SO4。
反应的化学方程式为: (并标出电子转移的数目和方向)。
26.(6分)A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子数是内层电子数的3倍。C原子的最外层电子数是内层电子数的一半,且C元素是植物生长的营养元素之一。D原子是短周期元素中原子半径最大的原子(除稀有气体)。
试写出:
(1) A、B元素形成的酸酐的化学式 ;
(2) D元素的单质与水反应的化学方程式 ;
(3) A、C元素气态氢化物的稳定性大小 < (用分子式表示)。
27.(10分)某同学设计右下图装置进行探究。(夹持装置已略去)
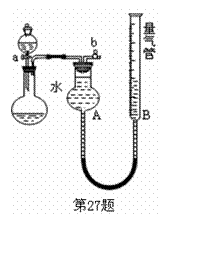 (1)进行“铜和稀硝酸反应制取NO”的实验。
(1)进行“铜和稀硝酸反应制取NO”的实验。
①制取NO的化学方程式:
②收集气体前必须先 然
后才开始收集气体。
(2)利用该装置制取并收集少量其他气体,请完成下表:
制取气体
药品
O2
、
某溶液、Al
(3)利用该装置进行实验,并根据产生氢气的量来确定某酸的结构:
①反应前,先对量气管进行第一次读数。读数时,应注意的操作是
,并使视线与凹液面最低处相平;反应后,待 时,再对量气管进行第二次读数。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
编号
酸的质量
金属锌的质量
量气管第一次读数
量气管第二次读数
1
40mL
264mL
2
30mL
228mL
3
20mL
243mL
已知该酸的相对分子质量为145。根据上述数据可确定该酸是 元酸;
③如果第二次对量气管读数时仰视,则测得的气体体积会 (填“偏高”、“偏低”或“不能确定”)。
28.(8分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
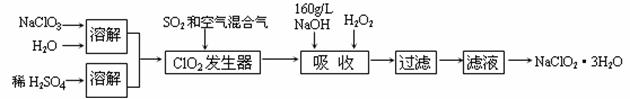
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2・3H2O。
②ClO2的沸点为283K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
③HClO2在
(1)
(2)ClO2发生器中所发生反应的化学方程式为 。
(3)吸收塔中为防止产生NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)从滤液中得到NaClO2・3H2O晶体还必须进行的操作是 (填操作名称)。
29.(6分)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体
(1)加入铝粉的质量。
(2)原硫酸铜溶液的物质的量浓度。
30.(10分)江苏东海有蛭石。蛭石为一种层状结构的含镁的水铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/3的Si被Al置换,再由K平衡其电荷形成的。
该矿石得组成以氧化物的形式表示为 。
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
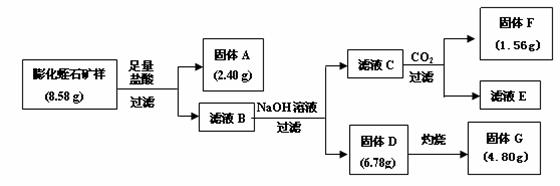 ① 固体A的化学式是
① 固体A的化学式是
② 固体F的物质的量是
③ 通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式。

