1. 焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是
A.非金属单质燃烧时火焰均为无色
B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察
D.NaC1与Na2CO3灼烧时火焰颜色相同
2. 2008年北京奥运会主体育场――“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N
C.用金属铝与V2O5冶炼钒,铝作还原剂
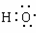 3. 下列有关化学用语的说法中不正确的是
3. 下列有关化学用语的说法中不正确的是
A.次氯酸的结构式为:H―Cl―O B.-OH 与 都表示羟基

 |
C.S2-的结构示意图:S2- D.苯分子的模型示意图:
4. 下列分子结构中,原子的最外层电子不能都满足8电子稳定结构的是
A.CS2 B.PCl
5.判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:元素化合价是否变化 B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小 D.金属晶体:晶体是否能够导电
6. 离子间能大量共存,当溶液中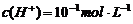 时有气体产生,而当溶液中
时有气体产生,而当溶液中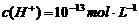 时又能产生沉淀。下列各组离子中符合上述要求的一组是
时又能产生沉淀。下列各组离子中符合上述要求的一组是
A、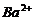
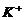
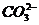
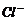 B、
B、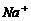

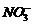
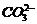
C、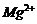
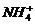
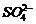
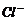 D、
D、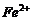
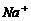
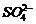
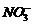
7.设NA表示阿伏加德罗常数。下列叙述正确的是
A.标准状况下,2.
B.
C.1 mol Cu与足量的S反应,转移的电子数为2NA
D.
8.下列反应的离子方程式书写正确的是( )
A.亚硫酸氢铵溶液与等物质的量的NaOH溶液混合:
NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
B.漂白粉溶液中通入适量的SO2气体
C a2++2ClO-+SO2+H2O = CaSO3↓+2HClO
C.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
AlO2―+4H+ =Al3++2H2O
D.Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++HCO3-+OH-=CaCO3↓+H2O
9.Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑ 对此反应下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2mol FeSO4发生反应时,共有10mol电子转移
10、类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中不正确的是
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO・Fe2O3;Pb3O4也可写成2PbO・PbO2
C.不能用电解熔融AlCl3来制取金属铝;也不用电解熔融MgCl2来制取金属镁
D.Fe与S直接化合生成FeS;Cu与S直接化合也可以得到Cu2S
11、据报道,2006年11月一名俄罗斯前特工在英国因钋中毒而死亡。已知钋单质为银白色金属,在黑暗中能发光,它有两种不同结构的单质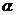 -Po和
-Po和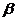 -Po,钋元素有质量数从192到218的全部核素,其常见化合价为+2、+4、+6。下列关于钋的叙述错误的是
-Po,钋元素有质量数从192到218的全部核素,其常见化合价为+2、+4、+6。下列关于钋的叙述错误的是
A.钋元素是由居里夫妇发现并命名的放射性元素
B.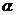 -Po和
-Po和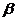 -Po是钋元素的同素异形体
-Po是钋元素的同素异形体
C.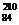 Po与
Po与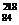 Po互为同位素
Po互为同位素
D.钋元素的相对原子质量是由钋的各种核素的质量数与其原子个数百分比的乘积求和得到的
12、固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构。则下列有关说法中错误的是
A、1molNH5中含有5NA个N―H键(NA表示阿伏加德罗常数的值)
B、NH5中既有共价键又有离子键,它形成的晶体是离子晶体
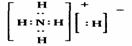
C、NH5的电子式为
D、它与水反应的化学方程式为NH5+H2O==NH3・H2O+H2↑
13.浅绿色的Fe(NO3)2溶液中存在平衡:Fe2++2H2O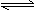 Fe(OH)2+2H+,若向溶液中加入稀盐酸,则溶液的颜色变化是
Fe(OH)2+2H+,若向溶液中加入稀盐酸,则溶液的颜色变化是
A.绿色变浅 B.绿色变深 C.变黄 D.不变
14. 下列除去杂质的方法中,正确的是
A、除去铜粉中混有的铁:加足量稀硝酸,过滤
B、除去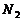 中少量的CO:通过足量灼热的
中少量的CO:通过足量灼热的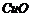 粉末
粉末
C、除去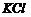 溶液中的少量
溶液中的少量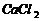 :加适量
:加适量 溶液,过滤
溶液,过滤
D、除去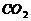 中的少量的
中的少量的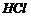 :通过足量的饱和碳酸氢钠溶液
:通过足量的饱和碳酸氢钠溶液
15. 有一未完成的离子方程式为 □ +XO3―+6H+==3X2+3H2O,据此判断X元素的最高化合价为
A.+1 B.+
16.下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.乙炔和乙烯使溴的四氯化碳溶液褪色
C.漂白粉和水玻璃长期暴露在空气中变质
D.氯水和活性炭使红墨水褪色
答案表:
题 号
1
2
3
4
5
6
7
8
答 案
题 号
9
10
11
12
13
14
15
16
答 案
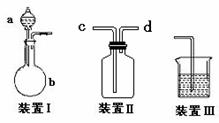 17.(11分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能。
17.(11分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能。
(1)甲认为装置Ⅰ可作为实验室快速制氧气的发生器,
则装置Ⅰ的a仪器中可加入 b仪器中加入 ;
或a仪器中可加入 b仪器中加入 。
装置Ⅱ从 管口进气可作为O2的收集装置。
(2)乙认为利用装置Ⅱ,可收集NO,试简述操作方法:
。
(3)丙认为利用装置Ⅰ和装置Ⅲ,可验证Cl2的氧化性比Br2强,进行此项实验时在装置Ⅰ中的a仪器中加入___________试剂,b仪器中加入________ 试剂,装置Ⅲ中应加入适量的 试剂,根据装置Ⅲ中观察到的 实验现象即可得出Cl2的氧化性比Br2强的结论。
18.( 12分) W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)、W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为:
(2)、W与Y可形成化合物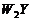 ,该化合物的电子式为
,该化合物的电子式为
(3)、证明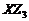 为共价化合物的方法是
为共价化合物的方法是
(4)、比较Y、Z气态氢化物的稳定性: > (用分子式表示)
(5)、W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是 > >
> (用离子符号表示)
(6)、Z的最高价氧化物为无色液体,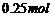 该物质与一定量水混合得到一种稀酸溶液,并放出
该物质与一定量水混合得到一种稀酸溶液,并放出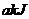 的热量。写出该反应的热化学方程式:
的热量。写出该反应的热化学方程式:
19.(6分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①、取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②、另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
则原溶液中肯定存在的离子是_____________,肯定不存在的离子是_____________
已知一定量的原溶液中加入5 mL
0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀
20、(11分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)、铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___________。(填序号)
A.铝与Cl―反应,铝与SO42―不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)、铝片表面出现的暗红色物质是 。
(3)、放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是
。
(4)、某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
21(12分)下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物(其中C为常见的两性氧化物)。试推断:
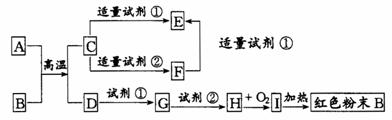
(1)写出物质的化学式:
A:_______ C:________ I:________
(2)写出下列反应的方程式:
C→F的离子方程式
H→I的化学方程式
 安徽省合肥市润安公学部分高中08-09学年高三上学期期中考试
安徽省合肥市润安公学部分高中08-09学年高三上学期期中考试
化学答题卷
题 号
1
2
3
4
5
6
7
8
答 案
题 号
9
10
11
12
13
14
15
16
答 案
17、(1)则装置Ⅰ的a仪器中可加入 b仪器中加入 ;
或a仪器中可加入 b仪器中加入 。
装置Ⅱ从 管口进气可作为O2的收集装置。
(2)乙认为利用装置Ⅱ,可收集NO,试简述操作方法:
。
(3)丙认为利用装置Ⅰ和装置Ⅲ,可验证Cl2的氧化性比Br2强,进行此项实验时在装置Ⅰ中的a仪器中加入___________试剂,b仪器中加入________ 试剂,装置Ⅲ中应加入适量的 __________试剂,根据装置Ⅲ中观察到的 实验现象即可得出Cl2的氧化性比Br2强的结论。
18.(1):
(2)
(3)
(4) > (用分子式表示)
(5) > > > (用离子符号表示)
(6)
19.__________________;___________________;______________。
20.(1)_______________;(2)___________________
(3)_______________;_______________________________________________
_____________________________________________________________________;
(4)_____________________.
21、(1)、A:_______ C:________ I:________
(2)______________________________________________;
_________________________________________________.
参 考 答 案
题 号
1
2
3
4
5
6
7
8
答 案
D
C
A
C
A
D
A
D
题 号
9
10
11
12
13
14
15
16
答 案
A
C
D
A
C
D
C
B
17(11分,第(2)小题2分,其余每空1分)
(1)H2O2溶液、MnO2粉末; 或H2O Na2O2; C。
(2)排水法收集-----------广口瓶中盛满水 , NO 从 d 管通入
(3)浓盐酸、KMnO4、NaBr溶液(合理得分)、溶液由无色变橙色(黄色)
18.(1)Al(OH)3+OH-=AlO2-+2H2O (2)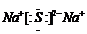 。
。
(3)酸 Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+2HCl (5)HCl>H2S
(6)S2->Cl >Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol。
19.( 6分) OH-、AlO2-、CO32-、K+ ;NH4+、SO42- 、SiO32- 、Al 3+ ;有Cl-。
20. (1)D(2分) (2)Cu(1分) (3)H2(1分);①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大,②该反应放热,升高温度反应加快,
③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
21.(共5分)(1)A: Al; C:Al2O3; I:Fe(OH)3
(2)Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-);
4Fe(OH)2+O2+2H2O 4Fe(OH)3(每空1分)

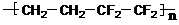 )是由两种单体缩聚而成的
)是由两种单体缩聚而成的