18.(9分)⑴、
甲醇的燃烧热为:________________________;
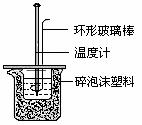
(2)、实验室用50 mL0.50 mol/L盐酸、50 mL0.55 mol/LNaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验次数
起始温度t1/℃
 终止温度
终止温度
t2/℃
盐酸
NaOH溶液
1
20.2
20.3
23.7
2
20.3
20.5
23.8
3
21.5
21.6
24.9
试回答下列问题:
①、实验时用环形玻璃棒搅拌溶液的方法是_________________________________,
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________________。
②、经数据处理,t2-t1=
(盐酸和NaOH溶液的密度按
③、若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1____________ΔH(填“<”、“>”或“=”),理由是________________________________________________________。
19.(10分)A、B、C、D、E均为短周期元素,且原子序数逐渐增大。A、D同主族,A与B的质子数之和等于C的质子数,A+离子与C2- 离子的核外电子数之和等于D+离子的核外电子数,B原子与D+离子的核外电子数之和等于E原子的核外电子数。
(1)、A、B、C、D、E的元素符号分别为________________________。
(2)、D、E元素可组成化合物甲,电解甲的水溶液时,反应的离子方程式为_____________________________________;A、C元素可组成原子个数比为1∶1的化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为_________________________________。
(3)A、B、C、E中的任意三种元素可组成多种化合物,其中既含离子键又含共价键,且水溶液呈酸性的化合物有__________________________。
(4)A、C、D、E中的任意三种元素可组成多种化合物,其中溶于水时能抑制水电离的化合物有(各写一种不同类别的化合物)____________________,它们能抑制水电离的理由是_____________________________________________。
20.(12分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
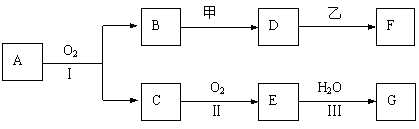 |
⑴若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
|

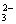 、NO
、NO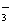 、SO
、SO 两两组合而成,它们的溶液发生如下反应:
两两组合而成,它们的溶液发生如下反应: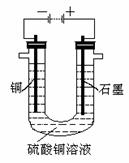 22.(9分)
22.(9分) 2Fe2O3+8SO2(2分)
2Fe2O3+8SO2(2分)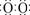 ]2-Na+ ( 2分)
]2-Na+ ( 2分) 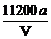 (2分)
(2分)