 A.原子核外最外层电子数:A>C>B
B.离子半径:A2->B2+>C-
A.原子核外最外层电子数:A>C>B
B.离子半径:A2->B2+>C-
C.B和C形成化合物的电子式为B2+[:C:]2 D.沸点:HC > H
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
9.NA代表阿伏加德罗常数,下列说法正确的是
A. pH为3的FeCl3溶液中,由水电离产生的H+离子数目为0.001NA
B.乙烯和丙烯的混合物
C.标准状况下,
D.0.1mol甲基(-CH3)所含电子数为0.8NA
10、下列离子方程式或化学方程式中正确的是
A.向Fe(OH)3中加入大量的氢溴酸:Fe(OH)3+3H+ = Fe3++3H2O
B.H218O中投入Na2O2固体: 2H218O+2Na2O2 ==4NaOH+18O2↑
C.往明矾溶液中加入氢氧化钡溶液至SO42_完全沉淀
Al3+ + 2SO42_ + 2 Ba2+ + 4OH- ==AlO2- + 2BaSO4↓+ 2H2O
D.硫酸氢铵稀溶液中滴加少量Ba(OH)2溶液:
Ba2+ + 2OH- + SO42_ + H+ + NH4+ ==BaSO4↓+ H2O + NH3・H2O
11、2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。 学科网
学科网 学科网
学科网

|

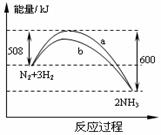 12、在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是
12、在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是 2NH3 △H=-92kJ/moL
2NH3 △H=-92kJ/moL
 提供的装置:
提供的装置: 模拟尾气的处理
模拟尾气的处理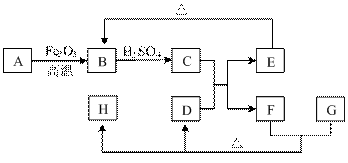
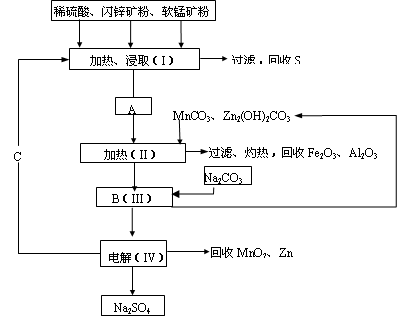 (2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。
(2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。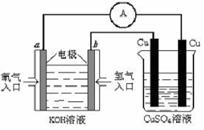
 2NH3(g);ΔH= -92.2 kJ・mol-1。
2NH3(g);ΔH= -92.2 kJ・mol-1。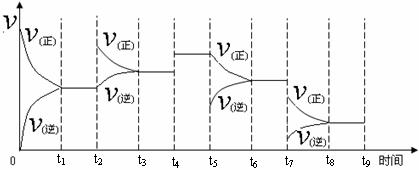
 H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol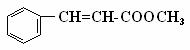 )常用于调制具有草莓、葡
)常用于调制具有草莓、葡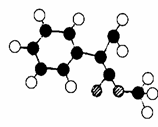 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如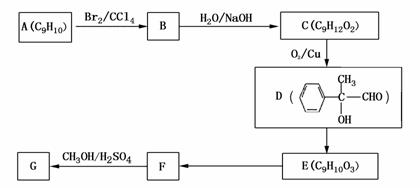 ?
? (4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是 。
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是 。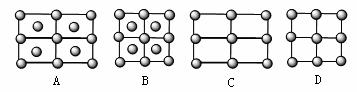
 球,镍原子用大
球,镍原子用大 球,镁原子用大
球,镁原子用大 球
球