21.(5分) (1)与16g氧气所含的分子数相同的氨气是 g;与16g氧气所含的原子总数相同的氨气是 g;相同条件下,在5.6g氮气中添加 g氨气,所组成的混合气体的体积与16g氧气所占的体积相等。
.(2)4.6g Na放在 g水中,才能使每10个水分子中溶有一个Na+。
22.(4分)合理利用化学反应可以造福人类。请写出下列反应的化学方程式、
(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路
(2)工业上使用漂白粉的原理
23.(7分)下图每一方格表示一种物质。通常状况下,A、C均为无色气体,B为无色液体。

请填写下列空白:
(1) 物质X可以是___________,C是____________,F是___________;
(2) 反应①的化学方程式是 。
(3) 反应②的离子方程式是 。
24.(4分)化学课上,围绕硫酸及其盐的性质进行如下探究,请你填写有关答案。
(1)取一小粒金属钠,小心放入盛有硫酸铜稀溶液的烧杯中,用漏斗倒扣在烧杯上,观察到金属钠在液面上四处游动,有大量气泡生成,收集产生的气体并点燃,火焰呈淡蓝色,该气体是 (填化学式)。溶液中同时有 (填化学式)不溶物生成。
(2)“绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线。若以铜为原料制取硫酸铜,请你设计符合“绿色化学”思想的反应路线(用化学方程式表示)。
。
25.(8分)胃酸过多是常见的胃病,胃酸的主要成分是盐酸。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:
26.(3分)已知Cl2+H2O=HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;
从集气瓶B中湿润的红色布条的现象可得出的结论是 。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
。
27.(11分).某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫外,还可能产生氢气。为验证甲、乙两同学的判断是否正确,丙同学设计了如下所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 。
(2)乙同学认为还可能产生氢气的理由是:
(3)丙同学在安装好装置后,必不可少的一步 操作是:
。
(4)A中加入的试剂可能是 作用是 。
B中加入的试剂可能是 作用是 。
E中加入的试剂可能是 作用是 。
(5)可以证明气体X中含有氢气的实验现象是:
C中: ,D中 ;
如果去掉装置B,还能否根据D中现象判断气体X中是否有氢气?
(填“能 ”或“不能” )。原因是:
。
28.(6分)在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有四座工厂:甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeC13、Ca(OH)2、HCl中的一种,某中学环保小组对河水监测发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清。④丁处产生气泡,河水仍清,请回答:
(1)四座工厂排出的废液里含有的污染物是:
甲 乙 丙 丁
(2)在丁的下游M处取出的河水中,肯定含有的离子是
(3)小河中鱼虾几乎绝迹的原因是
四. 计算题(共12分)
29.(4分)将2.44gBaCl2・xH2O晶体配成100mL溶液,其浓度为0.1mol・L-1。计算:
(1)BaCl2・xH2O晶体中的x= 。
(2)要沉淀25mL此溶液中的Cl-,需要0.2mol・L-1的AgNO3溶液 mL。
30.(8分)将10.5 g镁、铝混合物投入到200mL 6mol/L 的盐酸中全部溶解,放出气体的体积在标准状况下为12.32L。求在所得溶液中至少加入多少毫升浓度为3mol/LNaOH溶液,才能使镁、铝两元素以不同存在形式而分离开?
2006-2007学年度第一学期期末考试高一试卷
化学 答题纸
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
21.(1)
(2)
22. (1)
(2)
23. (1)
(2)
(3)
24.(1)
(2)
25. (1)
(2)
(3)
26. (1)
(2)
27.(1)
(2)
(3)
(4)
(5)
28.(1)
(2)
(3)
29.(1) (2)
30.(计算过程)
高一化学试题答案
1 A 2 D 3 D 4 A 5 D 6 D 7 A 8 B 9 D 10 C 11B 12 A 13 A 14. A 15A 16 C 17 A 18 C 19 B 20 B (各2分)
21.(1)8.5 、4.25、 5.1 (各1分) (2)39.6(2分)
22. (1) 2FeCl3 + Cu = CuCl2 + 2FeCl2
(2) Ca(ClO)2 + 2HCl = CaCl2 + 2HClO (各2分)
23. (1)(NH4)2CO3(或NH4HCO3);NH3;NO2
(各1分) (2)2Na2O2+2CO2=2Na2CO3+O2 (3)3Cu+2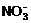 +8H+=3Cu2++4H2O+2NO↑(各2分)
+8H+=3Cu2++4H2O+2NO↑(各2分)
24.(1) H2 Cu(OH)2 (各1分)
(2) 2Cu + O2 = 2CuO CuO + H2SO4 = CuSO4 + H2O(各2分)
25. (1) NaHCO3; Al(OH)3(各1分)
(2) HCO3- + H+ = H2O +CO2↑
(3) Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O(各2分)
26. (1) Cl2没有漂白性; HClO有漂白性
(2)盐酸是否能使红布条褪色 (各1分)
27.(1) Zn+2H2SO4(浓)=ZnSO4+SO2↑+2 H2O (2分)
(2)当Zn 与浓硫酸反应时浓硫酸浓度逐渐变稀,Zn与稀硫酸反应可产生H2((1分)
(3)检查装置的气密性(1分) (4)品红溶液;检验SO2; 浓硫酸;吸收水蒸气;碱石灰;;防止空气中水蒸气进入D中(各0.5分)
(5)C中黑色固体变成红色;D中白色粉末变蓝色;不能;因为混合气体中可能含有水,会干扰H2的检验。(各1分)
28.(1)Ca(OH)2、FeCl3、HCl、Na2CO3(各1分)(2)Na+、Ca2+、Fe3+、H+、Cl-(3)河水中的酸、碱等有毒化学试剂直接危害鱼、虾的生存。(各1分)
29.(1)2 (2)25 mL(各2分)
30.500 mL (8分)

