
【题目】实验室制备无水二氯化锡的主要步骤如下:
步骤1:在圆底烧瓶中加入1.20 g碎锡箔和5 mL浓盐酸、1滴硝酸,实验装置如图所示。组装好后在95 ℃ 时回流0.5 h,待圆底烧瓶中只剩余少量锡箔为止;
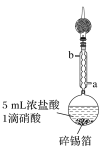
步骤2:将上述反应的上清液迅速转移到仪器X中,在二氧化碳气氛保护下,蒸发浓缩,冷却结晶,过滤得到二氯化锡晶体;
步骤3:在二氯化锡晶体中加入10 mL醋酸酐,即可得无水二氯化锡,过滤;
步骤4:用少量乙醚冲洗三次,置于通风橱内,待乙醚全部挥发后得到无水二氯化锡。
回答下列问题:
(1)步骤1中,圆底烧瓶中发生反应的化学方程式为___________________________________;
冷却水从接口________(填“a”或“b”)进入。实验采取的加热方式是______________;球形冷凝管上连接装有碱石灰的干燥管的目的是____________________________________。
(2)步骤2中,仪器X的名称为__________;二氧化碳气氛的作用是__________________。
(3)步骤3中,醋酸酐的作用是____________________;二氯化锡晶体在进行步骤3操作前应采取的加工措施是________,该加工措施需要仪器的名称是________。
【答案】Sn+2HCl(浓)![]() SnCl2+H2↑ a 95 ℃水浴加热 吸收HCl,防止HCl气体进入空气 蒸发皿 防止空气中的氧气氧化Sn2+ 吸水 研碎 研钵
SnCl2+H2↑ a 95 ℃水浴加热 吸收HCl,防止HCl气体进入空气 蒸发皿 防止空气中的氧气氧化Sn2+ 吸水 研碎 研钵
【解析】
(1)Sn和浓盐酸反应生成SnCl2和H2;冷凝管中的水是逆流的;温度小于100℃时采用水浴加热的方法;HCl会污染空气,所以尾气要处理;
(2)蒸发浓缩溶液的仪器是蒸发皿;Sn2+不稳定,易被空气氧化;
(3)醋酸酐能和水反应生成醋酸,则醋酸酐有吸水作用;只有二氯化锡的晶体表面积越大时,除去晶体中的水分才能越充分;研碎晶体的仪器是研钵;
(1)Sn和浓盐酸反应生成SnCl2和H2,反应的化学方程式为Sn+2HCl(浓)![]() SnCl2+H2↑,为了充分冷却蒸气且防止温度过高的蒸气急剧冷却而炸裂冷凝管,则冷凝管中的水是逆流的,所以a是进水口、b是出水口;温度小于100 ℃时采用水浴加热的方法,所以该实验的条件是95 ℃水浴加热;浓盐酸易挥发,挥发出的HCl会污染空气,所以尾气要处理,
SnCl2+H2↑,为了充分冷却蒸气且防止温度过高的蒸气急剧冷却而炸裂冷凝管,则冷凝管中的水是逆流的,所以a是进水口、b是出水口;温度小于100 ℃时采用水浴加热的方法,所以该实验的条件是95 ℃水浴加热;浓盐酸易挥发,挥发出的HCl会污染空气,所以尾气要处理,
故答案为:Sn+2HCl(浓)![]() SnCl2+H2↑ ; a ; 95 ℃水浴加热; 吸收HCl,防止HCl气体进入空气 ;
SnCl2+H2↑ ; a ; 95 ℃水浴加热; 吸收HCl,防止HCl气体进入空气 ;
(2)蒸发浓缩溶液的仪器是蒸发皿;Sn2+不稳定,易被空气氧化,故需要在二氧化碳气氛中进行,故答案为:蒸发皿 ; 防止空气中的氧气氧化Sn2+;
(3)醋酸酐能和水反应生成醋酸,则醋酸酐有吸水作用;二氯化锡的晶体表面积越大时,除去晶体中的水分越充分,所以在操作3之前必须将其研碎;研碎晶体的仪器是研钵,
故答案为:吸水 ; 研碎; 研钵。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中不正确的是( )
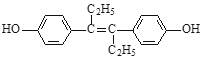
A. 己烯雌酚的分子式为C18H20O2
B. 己烯雌酚分子中一定有16个碳原子共平面
C. 己烯雌酚为芳香族化合物
D. 己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)回答下列问题:
①处于基态的Ca和Fe原子,下列参数前者小于后者的是_________;
a. 最外层电子数 b. 未成对电子数 c. 第一电离能 d. 原子半径
②有文献表明,迄今为止(至2016年)除氦外,所有其他稀有气体元素都能形成化合物。试简要说明未能制得氦的化合物的理由 _______________________。
(2)H和N可以形成多种化合物。
①已知联氨(N2H4)的物理性质与水接近,其原因是_____________________;
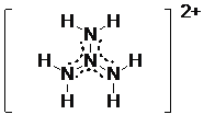
②计算表明: N4H62+ 的一种结构如图所示,氢原子只有一种化学环境,氮原子有两种环境,其中的大 π键可表示为_________________。
(3)晶体X只含钠、镁、铅三种元素。在不同的温度和压力下,晶体X呈现不同的晶相。
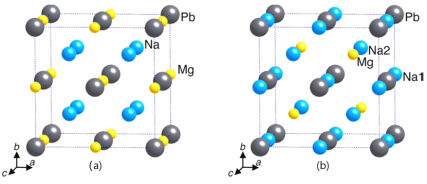
①γ-X 是立方晶系的晶体。铅为立方最密堆积,其余两种原子有选择的填充铅原子构成的四面体空隙和八面体空隙。在不同的条件下,γ-X 也呈现不同的结构,其晶胞如图所示。X的化学式为_____________;在(b)型晶胞中,边长为a pm,距离Pb最短的Na有_______个,长度为_______pm(用a表示);Na填充了晶胞中铅原子构成四面体空隙的百分比为________和八面体空隙的百分比为________。已知(a)型晶胞的边长为770 pm,则该型晶体的密度为_________g·cm-3。(只列出计算式)
②α-X是一种六方晶系的晶体,而在α-X中,镁和铅按 1:1 的比例形成类似于石墨的层状结构,钠填在层间。试画出一层α-X 的结构__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示。充电过程中,石墨电极发生阴离子插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是
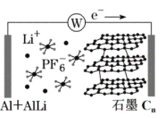
A.放电时,电解质中的Li+向左端电极移动
B.充电时,与外加电源负极相连一端电极反应为:AlLi-e-=Li++Al
C.放电时,正极反应式为Cn(PF6)+e-=PF6-+Cn
D.充电时,若转移0.2mol电子,则铝电极上增重5.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 20mL 0.5mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的说法错误的是( )
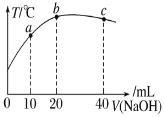
A.醋酸的电离平衡常数:b 点>a 点
B.由水电离出的 c(OH-):b 点>a 点
C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-)
D.b 点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx、SO2的处理转化对环境保护有着重要意义。
(1)利用反应2NO(g)+2CO(g) = N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=![]() ]的关系如图1所示。
]的关系如图1所示。
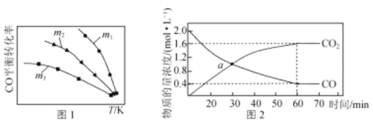
①该反应的ΔH ____0(填“>”“<”或“=”)。
②下列说法正确的是________(填字母)。
A.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B.投料比:m1>m2>m3
C.当投料比m=2时,NO转化率是CO转化率的2倍
D.汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为________。
(2)若反应2NO(g)+2CO(g) = N2(g)+2CO2(g)的正、逆反应速率可表示为:v正=k正·c2(NO) ·c2(CO);v逆=k逆·c (N2) ·c2(CO2), k正、k逆分别为正、逆反应速率常数, 仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时v正∶v逆=________。
(3)工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图3为298K各气体分压(气体的物质的量分数与总压的乘积)与CO物质的量分数的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。
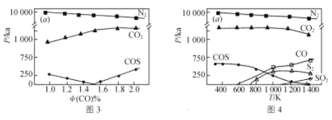
下列说法不正确的是________(填字母)。
A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种
B.温度越高脱硫脱硝的效果越好
C.NOx比SO2更易被CO还原
D.体系中可能发生反应:2COS = S2+2CO;4CO2+S2 = 4CO+2SO2
(4)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图5所示,则总反应方程式为________。

(5)用间接电化学法去除烟气中NO的原理如图6所示,则阴极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里,从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质 LiCoO2)中,回收钴、锂的操作流程如图所示:
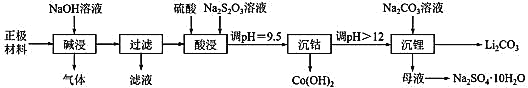
回答下列问题。
(1)拆解废旧电池获取正极材料前,先将其浸入 NaCl 溶液中,使电池短路而放电,此时溶液温度升高,该过程中能量的主要转化方式为_____。
(2)“碱浸”过程中产生的气体是_____;“过滤”所得滤液用盐酸处理可得到氢氧化铝,反应的化学方程式为_________。
(3)“酸浸”时主要反应的离子方程式为_____;若硫酸、Na2S2O3 溶液用一定浓度的盐酸替代,也可以达到“酸浸”的目的,但会产生_________(填化学式)污染环境。
(4)“沉钴”时,调 pH 所用的试剂是_____;“沉钴”后溶液中 c(Co2+)=_____。(已知:Ksp[Co(OH)2]=1.09×l0-15)
(5)根据如图判断,“沉锂”中获得Li2CO3 固体的操作主要包括_______、_______、洗涤、干燥等步骤。
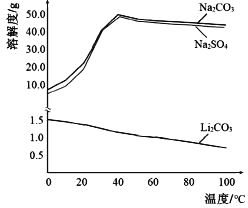
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 根据如表所列数据判断,错误的是
根据如表所列数据判断,错误的是
元素 |
|
|
|
|
X | 496 | 4562 | 6912 | 9543 |
Y | 578 | 1817 | 2745 | 11575 |
A. 元素X的常见化合价是![]() 价
价
B. 元素Y是ⅢA族元素
C. X单质的熔点高于Y单质的熔点
D. 若元素X处于第3周期,它的单质可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扎实的实验知识对学习有机化学至关重要。
(1)实验室用纯溴和苯在铁离子催化下反应制取溴苯,得到粗溴苯后,粗溴苯的精制常进行如下操作:a.蒸馏 b.水洗、分液 c.用干燥剂干燥 d.10%的NaOH溶液碱洗、分液。正确的操作顺序是________。
A.abcdb B.bdbca C.dbcab D.bdabc
分液时上层液体应从________________(填“上口倒出”“下导管直接流出”),蒸馏时所需仪器除酒精灯、温度计、蒸馏烧瓶、牛角管、锥形瓶外还需要的玻璃仪器为______。
(2)下列各组试剂中,能鉴别乙醇、己烷、己烯、乙酸溶液、苯酚溶液等五种无色溶液的是________。
A.金属钠、FeCl3溶液、NaOH溶液
B.新制的Cu(OH)2悬浊液、紫色石蕊溶液
C.紫色石蕊溶液、溴水
D.溴水、新制的Cu(OH)2悬浊液
(3)溴乙烷与氢氧化钠的乙醇溶液共热产生的气体通入酸性高锰酸钾溶液中,溶液褪色,不能说明产生的气体为乙烯的原因是_________。
(4)某有机物的相对分子质量为102,经红外光谱测定,该有机物分子中含有一个羧基、一个羟基和一个碳碳双键,则其可能的结构简式为____(提示:羟基不能连在碳碳双键上)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com