【题目】已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题:
(1)Lv在周期表中的位置是_________。
(2)下列有关性质的比较,能用元素周期律解释的是_________。
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________。
(4)实验室用如下方法制备H2S并进行性质验证。
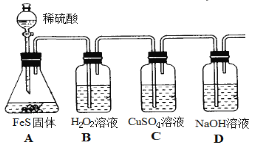
①设计B装置的目的是证明_________,B中实验现象为_______________。
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________。
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________。
【答案】第七(或7)周期VIA族 abd Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4 H2S具有还原性 出现淡黄色(或乳白色)沉淀(或浑浊) Cu2++H2S==CuS↓+2H+ 该反应发生的原因是生成了难溶的CuS沉淀,不是因为生成弱电解质
【解析】
(1)根据 O、S、Se、Te、Po、Lv都是氧族元素,且原子序数依次增大分析解答;
(2)根据元素的非金属性、氢化物的稳定性、最高价氧化物的水化物的酸性等元素周期律的变化规律分析判断;
(3)Se与S是同主族元素,最外层电子数相等,Se比S电子层数多、半径大,结合核对最外层电子的吸引力的变化,引起非金属性的变化分析解答;
(4)①双氧水具有较强的氧化性,H2S具有还原性;②硫化氢能够与硫酸铜反应生成黑色不溶于硫酸的CuS沉淀;③结合装置A和C中发生反应的原理分析解答。
(1) O、S、Se、Te、Po、Lv是同主族元素,都是氧族元素,位于第VIA族,O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大,因此Lv位于第七(或7)周期,在周期表中的位置为,故答案为:第七(或7)周期VIA族;
(2)a.同一主族元素,从上到下,离子半径逐渐增大,因此离子半径:Te2->Se2-,能用元素周期律解释,故a选;b.同一主族元素,从上到下,非金属性逐渐减弱,氢化物的稳定性减弱,因此热稳定性:H2O>H2S,能用元素周期律解释,故b选;c.物质的熔沸点是物理性质,不能用元素周期律解释,故c不选;d.同一主族元素,从上到下,非金属性逐渐减弱,最高价含氧酸的酸性减弱,因此酸性:H2SO4>H2SeO4,能用元素周期律解释,故d选;故答案为:abd;
(3)Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4,故答案为:Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4;
(4)①双氧水具有较强的氧化性,H2S具有还原性,能够被双氧水氧化生成硫单质沉淀,故答案为:H2S具有还原性;出现淡黄色沉淀;
②硫化氢能够与硫酸铜反应生成黑色不溶于硫酸的CuS沉淀,反应的离子方程式为Cu2++H2S==CuS↓+2H+,故答案为:Cu2++H2S==CuS↓+2H+;
③根据“强酸制弱酸”的原理,装置A中硫化亚铁与硫酸反应生成硫化氢,因为硫化亚铁能够被硫酸溶解,C中发生Cu2++H2S==CuS↓+2H+,是因为生成的硫化铜不能溶于硫酸,因此该反应能够发生,故答案为:该反应发生的原因是生成了难溶的CuS沉淀,不是因为生成弱电解质。

