【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答下列问题:
(1)写出元素E在周期表中的位置:;判断物质X中存在的化学键类型 .
(2)C、D、E分别形成的简单离子半径由大到小的顺序是:(用离子符号表示);C、E氢化物的热稳定性比较(用具体物质化学式比较).
(3)B元素的氢化物可以在实验室中制取, 
①写出B元素氢化物的电子式,其实验室发生装置可以选择如图中的 , 常用的实验室制备反应的化学方程式为 .
②欲制备并收集一瓶干燥的该气体,选择如图中的装置,其连接顺序为:(按气流方向,用导管口字母表示) .
③欲证明上述盐X溶液中含有的阳离子,其方法是 .
(4)E的最高价态与A、B、C三种元素形成的酸式盐Y在水溶液中的电离方程式是 .
参考答案:
【答案】
(1)第3周期,第ⅥA族;离子键、共价键
(2)S2﹣>O2﹣>Na+;H2O>H2S
(3)A;2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;a→d→c→f→e→i;取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+
CaCl2+2NH3↑+2H2O;a→d→c→f→e→i;取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+
(4)NH4HSO4=NH4++H++SO42﹣
【解析】解:(1)硫元素有三个电子层,最外层6个电子,所以是第3周期,第ⅥA族;X为NH4NO3 , 中存在离子键、共价键,所以答案是:第3周期,第ⅥA族;离子键、共价键;(2)电子层数越多半径越大,电子层数相同核电荷数越多半径越小,所以半径大小为:S2﹣>O2﹣>Na+;非金属性越强氢化物越稳定,所以稳定性:H2O>H2S,所以答案是:S2﹣>O2﹣>Na+;H2O>H2S;(3)①B元素的氢化物分子式是NH3 , 氢化物的电子式为: ![]() ,其实验室发生装置可以选择如图中的A实验室制取,反应的化学方程式为:Ca(OH)2+2NH4Cl
,其实验室发生装置可以选择如图中的A实验室制取,反应的化学方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,所以答案是:
CaCl2+2NH3↑+2H2O,所以答案是: ![]() ;A;2NH4Cl+Ca(OH)2
;A;2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;②欲制备并收集一瓶干燥的该气体,根据氨气是碱性气体,选用C装置干燥,氨气的密度小于水用向上排空气法,氨气的尾气除理用水吸收,所以其连接顺序为:a→d→c→f→e→i,所以答案是:a→d→c→f→e→i;③铵根离子的检验方法是取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+ , 所以答案是:取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+;(4)E的最高价态与A、B、C三种元素形成的酸式盐Y是NH4HSO4 , 电离方程式为:NH4HSO4=NH4++H++SO42﹣ , 所以答案是:NH4HSO4=NH4++H++SO42﹣ .
CaCl2+2NH3↑+2H2O;②欲制备并收集一瓶干燥的该气体,根据氨气是碱性气体,选用C装置干燥,氨气的密度小于水用向上排空气法,氨气的尾气除理用水吸收,所以其连接顺序为:a→d→c→f→e→i,所以答案是:a→d→c→f→e→i;③铵根离子的检验方法是取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+ , 所以答案是:取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+;(4)E的最高价态与A、B、C三种元素形成的酸式盐Y是NH4HSO4 , 电离方程式为:NH4HSO4=NH4++H++SO42﹣ , 所以答案是:NH4HSO4=NH4++H++SO42﹣ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】室温下,用0.1mo1/LHCl溶液滴定10.mL0.1mol·L-1Na2CO3溶液,滴定曲线如图所示。下列说法正确的是( )
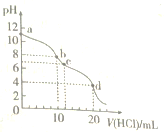
A. 水电离程度由大到小的顺序为:a>b>c>d
B. a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
C. b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. d点时:c(H+)>c(HCO3-)=c(CO32-)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中,含有自由氯离子的是( )
①食盐溶液 ②氯化氢溶液 ③氯酸钾 ④液态氯化氢 ⑤氯水
A.①②③B.②③④C.③④⑤D.①②⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,分别将四块形状相同、质量均为7 g的铁片同时放入下列四种溶液中,产生气体速率最快的是( )
A.150 mL 2 mol·L-1盐酸
B.500 mL2mol·L-1硫酸
C.50 mL 3 mol·L-1盐酸
D.50 mL 18.4 mol·L-1硫酸 -
科目: 来源: 题型:
查看答案和解析>>【题目】为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶解于水,然后进行以下操作:①过滤 ②加过量NaOH溶液 ③加入适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是( )
A.④①③⑤②B.①④③⑤②C.⑤②④①③D.③④①②⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】常用药品羟苯水杨胺,其合成路线如图.回答下列问题:
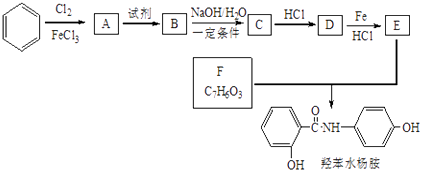
已知: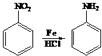
(1)羟苯水杨胺的分子式为 . 对于羟苯水杨胺,下列说法正确的是(填序号).
a.1mol羟苯水杨胺最多可以和2mol NaOH反应
b.不能发生硝化反应
c.可发生水解反应
d.可与溴发生取代反应
(2)D的名称为 .
(3)A→B所需试剂为;D→E反应的有机反应类型是 .
(4)B→C反应的化学方程式为 .
(5)写出 F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的,且其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的一种结构简式 . -
科目: 来源: 题型:
查看答案和解析>>【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)
 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
相关试题

