【题目】铜的化合物在工农业生产和化学实验室中都具有重要的作用。工业上常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合溶液来吸收一氧化碳(醋酸根离子CH3COO简写为Ac),反应方程式为:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
(1)Cu2+基态核外电子排布式为_________。
(2)该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为_________。
(3)CH3COOH分子中C原子的杂化类型为__________。
(4)配合物[Cu(NH3)3CO]Ac的中心离子的配位数为________。写出一种与NH3分子互为等电子体的阳离子的化学式____________。
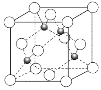
(5)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图所示(黑球代表铜原子)。该晶体的化学式为_____________。
【答案】1s22s22p63s23p63d9 N>O>C sp3、sp2 4 H3O+ CuCl
【解析】
(1)根据构造原理,按能级能量从低到高排列,然后将同一能层的能级排列在一起写出Cu原子的电子排布式,再由外向内失去电子,得到Cu2+的电子排布式;
(2)该反应中含有的第二周期非金属元素为C、N、O。根据同周期从左至右,元素的第一电离能总体上呈增大的趋势,可以判断元素的第一电离能大小,但注意第ⅡA和第ⅤA族元素原子的最外层电子分别为全充满和半充满状态,其第一电离能大于同周期相邻元素,据此可判断三种元素的第一电离能大小关系。
(3)利用杂化轨道数=中心原子的孤电子对的对数+中心原子的σ键个数进行判断;
(4)由配合物[Cu(NH3)3CO]Ac的分子式可知,Cu为中心原子,提供空轨道,NH3、CO为配体,由分子式可知配位数为4;原子总数相同,价电子总数相同的分子或离子互为等电子体,据此可写出NH3的等电子体。
(5)根据A原子的价电子排布式3s23p5推断出A为Cl原子,利用“均摊法”计算分析得出晶体的化学式。
(1)铜元素为29号元素,原子核外有29个电子,失去2个电子形成Cu2+,所以Cu2+的电子排布为1s22s22p63s23p63d9;答案为:1s22s22p63s23p63d9;
(2)该反应中第二周期的非金属元素为碳、氮、氧三种元素,根据同一周期从左到右第一电离能呈增大趋势,但氮元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故答案为:N>O>C;
(3)甲基(CH3)中原子形成4个单键,杂化轨道数目为4,采用的是sp3杂化;羧基(COOH)中碳原子形成3个σ键,杂化轨道数目为3,采用的是sp2杂化;
(4)配合物[Cu(NH3)3CO]Ac配体为NH3和CO,配位数为4;NH3的等电子体根据等电子原理即可写出,为H3O+。答案为:4;H3O+;
(5)A原子的价电子排布式为3s23p5,A是Cl。铜与Cl形成化合物的晶胞如图所示,其中铜全部在晶胞中,共计4个。氯原子的个数是![]() ,该晶体的化学式为CuCl。答案为:CuCl。
,该晶体的化学式为CuCl。答案为:CuCl。

