【题目】有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式:_________。
(2)用轨道表示式表示D元素原子的价电子构型:________。
(3)写出E离子的结构示意图:_________。
(4)元素B与D的电负性的大小关系:B________D,C与E的第一电离能的大小关系:C________E。(填>、<、=)
(5)由这五种元素组成的一种化合物是(写化学式)________。写出该物质的一种主要用途:________。
【答案】1s22s22p63s23p1 ![]()
![]()
 > > KAl(SO4)2·12H2O 净水剂
> > KAl(SO4)2·12H2O 净水剂
【解析】
A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,B和D处于同主族,它们原子最外层的p能级电子数是s能级电子数的两倍,外围电子排布为ns2np4,则B为O元素、D为S元素;C原子最外层上电子数等于D原子最外层上电子数的一半,最外层电子数为3,且为金属元素,故C为Al元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,A原子序数小于O元素,E原子序数大于Al元素,则A为H元素、E为K元素,据此进行解答。
根据上述分析可知A是H,B是O,C是Al,D是S,E是K元素。
(1)C是Al元素,基态Al原子的电子排布式是1s22s22p63s23p1;
(2)D为S元素,S原子的最外层含有6个电子,其基态原子的外围电子排布式为:3s23p4,其价电子的轨道表达式为:![]() ;
;
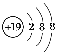
(3)E是19号K元素,K+核外电子排布为2、8、8,所以K+离子的结构示意图为 ;
;
(4)同主族元素从上到下元素的电负性逐渐减小,则元素电负性为O>S;元素的金属性越强,其第一电离能就越小,由于元素的金属性K>Al,所以元素第一电离能为Al>K;
(5)由以上分析可知A为H,B为O,C为Al,D为S,E为K,由这五种元素组成的一种化合物是KAl(SO4)212H2O,该物质溶于水电离产生的Al3+发生水解反应产生Al(OH)3胶体,Al(OH)3胶体表面积大,吸附力强,能够吸附水中悬浮的固体小颗粒,使之形成沉淀,从而使水澄清,因此具有净水作用,所以KAl(SO4)212H2O可作净水剂。

