【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
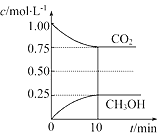
(1)能说明该反应已达平衡状态的是________(填编号)。
A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
(2)若要使K=1,则改变的条件可以是________(填选项)。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂。
参考答案:
【答案】BC D
【解析】
(1)①平衡状态可以根据两个方两去判断,一、是看正逆反应速是否相等,二是各组分的浓度是否随时间的改变而改变;也可以抓住变量不变来解分析;
(2)先计算该温度下此反应的平衡常数,根据平衡常数只与温度有关,分析若使该反应K=l需要改变的条件。
(1)①A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O,不能反映正逆反应速率之间的关系,故不选A错误;
B.反应过程中CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故选B;
C.根据 ,反应过程中,混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故选C;
,反应过程中,混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故选C;
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的浓度不再随时间的变化而变化,故不选D。
(2) 通入2mol CO2和3mol H2,根据图示,

![]() 0.20,
0.20,
平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,若要使K=1,则改变的条件可以是降温,选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一固定体积的密闭容器中,加入2mol A和1mol B发生可逆反应2A(g)+B(g)3C(g)+D(g),达到平衡,C的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是( )
A.4 mol A+2 mol B B.1 mol B+3 mol C+1 mol D
C.3 mol C+2 mol D D.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
-
科目: 来源: 题型:
查看答案和解析>>【题目】反应mA(s)+nB(g)
 pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是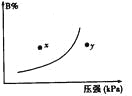
①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大
A.①②⑤B.②④⑤
C.只有①③D.①③⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。由图中数据该反应的化学方程式为:________。反应开始至2min,Z的平均反应速率为________

-
科目: 来源: 题型:
查看答案和解析>>【题目】室温下,0.1mol·L-1的某二元酸H2A溶液中,逐渐加入NaOH溶液,可能存在的含A粒子的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
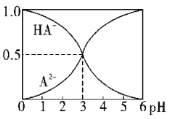
A.H2A的电离方程式:H2A
 H++HA-
H++HA-B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-)
D.Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
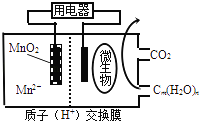
A.放电过程中,H+从正极区移向负极区
B.分子组成为Cm(H2O)n的物质一定是糖类
C.微生物所在电极区放电时发生还原反应
D.左边电极反应式为:MnO2+4H++2e﹣=Mn2++2H2O
相关试题

