已知:H2A的A2-可表示S2-、S
、S
、Si
或C
离子.
(1)常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:
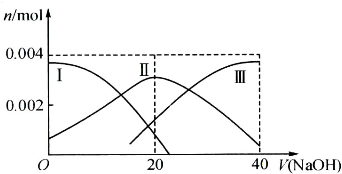
①当V(NaOH)=20mL时,溶液中离子浓度大小关系: ;
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 .
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ•mol-1;
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ•mol-1.
则Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3= kJ•mol-1;
工业上制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是 .
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= .
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 3 |
(1)常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:

①当V(NaOH)=20mL时,溶液中离子浓度大小关系:
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ•mol-1;
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ•mol-1.
则Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3=
工业上制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=
分析:(1)①根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A═NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
②氢离子或氢氧根离子抑制水的;根据HA-的电离程度和水解程度相对大小判断;
(2)根据盖斯定律解答;
(3)二者等体积混合溶液呈中性,说明酸中氢离子物质的量浓度和碱中氢氧根离子的物质的量浓度相等,从而得出KW.
②氢离子或氢氧根离子抑制水的;根据HA-的电离程度和水解程度相对大小判断;
(2)根据盖斯定律解答;
(3)二者等体积混合溶液呈中性,说明酸中氢离子物质的量浓度和碱中氢氧根离子的物质的量浓度相等,从而得出KW.
解答:解:(1)①当V(NaOH)=20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
②加入等体积的氢氧化钠时,HA-的电离程度大于水解程度,则NaHA溶液呈酸性,电离出的氢离子抑制水电离,所以使得溶液中水的电离程度比纯水的电离程度小,欲使溶液呈中性,可以加入碱液,
故答案为:小;碱;
(2)①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ•mol-1 Ⅰ
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ•mol-1 Ⅱ
将方程式Ⅰ+2Ⅱ得Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3=+1 011.0kJ•mol-1+2(-221.0kJ•mol-1)=+569kJ/mol,
制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是使硫酸钠得到充分还原,
故答案为:+569.0;使硫酸钠得到充分还原;
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,说明酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,二者体积相等,酸中氢离子浓度等于碱中氢氧根离子浓度,硫酸中氢离子浓度为0.01mol/L,pH=11的溶液中氢氧根离子浓度=KW10-11 mol/L,
所以0.01mol/L=KW10-11 mol/L,
所以KW=10-13,
故答案为:10-13.
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
②加入等体积的氢氧化钠时,HA-的电离程度大于水解程度,则NaHA溶液呈酸性,电离出的氢离子抑制水电离,所以使得溶液中水的电离程度比纯水的电离程度小,欲使溶液呈中性,可以加入碱液,
故答案为:小;碱;
(2)①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ•mol-1 Ⅰ
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ•mol-1 Ⅱ
将方程式Ⅰ+2Ⅱ得Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3=+1 011.0kJ•mol-1+2(-221.0kJ•mol-1)=+569kJ/mol,
制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是使硫酸钠得到充分还原,
故答案为:+569.0;使硫酸钠得到充分还原;
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,说明酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,二者体积相等,酸中氢离子浓度等于碱中氢氧根离子浓度,硫酸中氢离子浓度为0.01mol/L,pH=11的溶液中氢氧根离子浓度=KW10-11 mol/L,
所以0.01mol/L=KW10-11 mol/L,
所以KW=10-13,
故答案为:10-13.
点评:本题考查了弱电解质的电离、酸碱混合溶液定性判断、盖斯定律等知识点,难点是离子浓度大小是判断,根据溶液中的溶质电离和水解程度相对大小分析解答,难度中等.

