
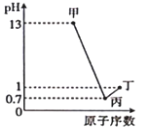
【题目】甲、乙、丙、丁分别为A、B、C、D四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是( )
A.简单离子半径: D>C>B>A
B.A、C形成的化合物水溶液呈碱性
C.C、D形成的氢化物稳定性:C>D
D.A、B分别与D形成的化合物均为离子化合物
【答案】B
【解析】
A、B、C、D为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,由图可知,0.1molL1甲溶液的pH=13,说明甲是一元强碱,则甲为NaOH、A为Na,0.1molL1丁溶液的pH=1,说明丁为一元强酸,又因原子序数D大于A,则丁为HClO4、D为Cl元素,0.1molL1丙溶液的pH=0.7,说明丙为二元强酸,则丙为H2SO4、C为S元素,常温下甲、丙、丁均可与乙反应,说明乙具有两性,则乙为Al(OH)3、B为Al元素,综上A是Na,B为Al元素,C为S元素,D为Cl元素,结合元素化合物性质判断解答。
A.同一周期从左至右阳离子半径逐渐减小,阴离子半径也逐渐减小,但阴离子半径大于阳离子半径,所以离子半径:C>D>A>B,故A错误;
B.Na与S形成的Na2S是弱酸强碱盐,因S2水解使溶液呈碱性,故B正确;
C.同周期元素从左到右,非金属性依次增强,氢化物稳定性依次增强,所以稳定性HCl>H2S,故C错误;
D.Na与Cl形成的NaCl是离子化合物,Al与Cl形成的AlCl3是共价化合物,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 0 mol·L-1NH4Cl溶液中逐滴加入0.100 0 mol·L-1KOH溶液时,溶液的pH与KOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
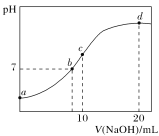
A.点a所示溶液中水的电离程度小于相同温度下纯水的电离程度
B.点b所示溶液中:c(NH4+)=c(K+)=c(H+)=c(OH-)
C.点d所示溶液中的溶质为一水合氨
D.点c所示溶液中:c(K+)+c(H+)=c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,[H+]和[OH-]的关系如图所示:
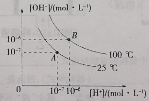
(1)A点水的离子积常数____(填“>”、“=”或“<”)B点水的离子积常数,造成水的离子积常数变化的原因是____。
(2)25℃时,若向水中滴加稀硫酸,___(填“能”或“不能”)使体系处于A点状态,原因是___。
(3)100℃时,若稀硫酸中由水电离产生的[H+]=1×10-8 mol·L-1,则稀硫酸的pH=_____,用pH试纸测定溶液的pH时,正确操作是____。
(4)100℃时将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2mol/LNH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O)
),c(H2CO3)>c(NH3H2O)
B.0.2mol/L氨水:0.2mol/L>c(OH-)+ c(NH3H2O)
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2的盐酸与pH=12的氨水等体积混合:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
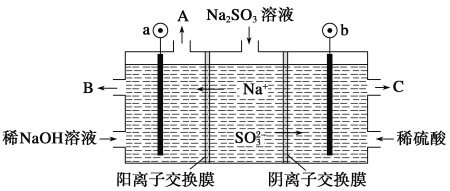
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图,下列关于分枝酸的叙述正确的是
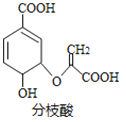
A.分子中含有5种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到预期目的的是
实验方案 | 实验目的 | |
A | 向两支试管中分别加入 | 探究 |
B | 取 | 配制8%的 |
C | 将 | 比较 |
D | 测同温同浓度 | 比较硫和硅两元素非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL 0.2 mol/L的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )

A.A点对应的I2的物质的量为1.0×10-3 mol
B.oa : ab = 4 : 1
C.当溶液中的n(I2) = 5×10-4 mol时,加入NaHSO3的物质的量可能为2.5×10-3 mol或5.5×10-3 mol
D.由ab段反应可知,氧化性I2 >![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com