【题目】合成氨工业生产中所用的a-Fe催化剂的成分为FeO、Fe2O3。
(1)某种a-Fe催化剂中铁、氧的物质的量之比为5:6,其中二价铁与三价铁的物质的量之比为_________________。
(2)当催化剂中二价铁与三价铁的物质的量之比为1:2时,其催化剂活性最高,此时该催化剂中铁的质量分数为_________________(用小数表示,精确到0.01)。
(3)以Fe2O3为原料制备上述催化剂,可向Fe2O3中加入适量炭粉,发生反应:2Fe2O3+C![]() 4FeO+CO2↑。为制得这种活性最高的催化剂,理论上应向320g Fe2O3粉末中加入炭粉的质量为________________,生成实验条件下CO2的体积为______________(假设此实验条件下,气体摩尔体积为24L/mol)。
4FeO+CO2↑。为制得这种活性最高的催化剂,理论上应向320g Fe2O3粉末中加入炭粉的质量为________________,生成实验条件下CO2的体积为______________(假设此实验条件下,气体摩尔体积为24L/mol)。
参考答案:
【答案】 3:2 0. 72 4 g 8L
【解析】试题分析:本题考查以物质的量为中心的计算、物质的量应用于化学方程式中的计算。
(1)设FeO、Fe2O3物质的量依次为x、y,则(x+2y):(x+3y)=5:6,解得x:y=3:1,FeO与Fe2O3物质的量之比为3:1,则二价铁与三价铁物质的量之比为3:(1![]() 2)=3:2。
2)=3:2。
(2)当催化剂中二价铁与三价铁的物质的量之比为1:2时,FeO与Fe2O3物质的量之比为1:1,则该催化剂中铁的质量分数为![]() =0.72。
=0.72。
(3)n(Fe2O3)=![]() =2mol,催化活性最高的催化剂中FeO与Fe2O3物质的量之比为1:1,设与C反应的Fe2O3物质的量为z,反应生成FeO物质的量为2z,则
=2mol,催化活性最高的催化剂中FeO与Fe2O3物质的量之比为1:1,设与C反应的Fe2O3物质的量为z,反应生成FeO物质的量为2z,则![]() =
=![]() ,解得z=
,解得z=![]() mol;根据反应的方程式2Fe2O3+C
mol;根据反应的方程式2Fe2O3+C![]() 4FeO+CO2↑,反应消耗C的物质的量为
4FeO+CO2↑,反应消耗C的物质的量为![]() mol,生成CO2物质的量为
mol,生成CO2物质的量为![]() mol,加入炭粉的质量为
mol,加入炭粉的质量为![]() mol
mol![]() 12g/mol=4g,生成实验条件下的CO2的体积为
12g/mol=4g,生成实验条件下的CO2的体积为![]() mol
mol![]() 24L/mol=8L。
24L/mol=8L。
-
科目: 来源: 题型:
查看答案和解析>>【题目】上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的方法。其中塑料袋、废纸、旧橡胶制品等属于( )
A. 无机物 B. 有机物 C. 盐类 D. 非金属单质
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化钠与盐酸的反应属于
A.吸热反应
B.放热反应
C.既是吸热反应也是放热反应
D.都不是
-
科目: 来源: 题型:
查看答案和解析>>【题目】在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:

(1)步骤③加Fe粉的目的是 。
(2)写出步骤④中反应的离子方程式 。
(3)上述生产流程中,可以循环利用的副产物是 。
(4)操作⑤的名称是 ,选用的试剂是 。
(5)AgI见光易变黑,其原因(用化学方程式表示) ,写出AgI两种主要用途 和 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。且含B元素物质的大量燃烧是形成酸雨的主要原因之一。

(1)写出A、B、C三种元素的名称___、_____、___。
(2)A元素位于元素周期表中第___周期,第___族。
(3)B的原子结构示意图为___,用电子式表示元素B的钠盐的形成过程:___。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有___。
(5)A和C氢化物哪个更稳定:________(写出该氢化物的化学式)
-
科目: 来源: 题型:
查看答案和解析>>【题目】浓度均为0.01 mol·L-1Na2CO3和NaHCO3的混合溶液中,下列说法正确的是
A. c(HCO
 )略大于c(CO
)略大于c(CO )
)B. c(H2CO3)略大于c(OH-)
C. c(Na+)等于c(CO
 )与c(HCO
)与c(HCO )之和
)之和D. c(OH-)略大于c(HCO3-)
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属钠与水的反应是中学化学中的一个重要反应。高一化学教材中该实验曾出现过几种不同的演示方法。分别如下图中(A)(B)(C)所示:
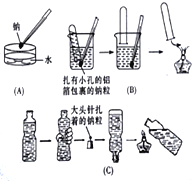
(1)现按图(A)所示的方法,在室温时,向盛有饱和Na2CO3溶液(滴有几滴酚酞)的烧杯中,加入一小块金属钠。
①下列现象描述正确的是_______(填字母代号)。
A.钠浮在液面上,并四处游动,最后消失 B.反应过程中钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色 D.恢复到室温时,烧杯底部有固体物质析出
②请补充并完成该实验从试剂瓶中取出钠到向烧杯中投入钠的有关操作:
用镊子从试剂瓶中取出一小块钠→_______________→用镊子夹取切好的金属钠投入到盛有饱和Na2CO3溶液的烧杯中。
(2)按图(C)所示的方法进行该实验,若500mL的矿泉水瓶开始时装有477.6mL水,要使倒置的矿泉水瓶正好恢复原状,假设矿泉水瓶内外均为标准状况,则大头针上扎着的钠粒质量为_______g。
(3)1998年全国高考试题中的实验题就是根据图(B)的原理设计的。题目及部分答案如下:
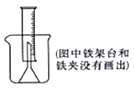
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、长颈漏斗、玻璃棒、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
Ⅰ.补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。……
[答案]
Ⅰ.②往烧杯中注入水,直至水面没过漏斗颈。[评分标准,凡加水改为加酸者,不论其他后续步骤是否正确,本小题一律0分]
③在100毫升量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中。烧杯中水面到杯口至少保留约100毫升空间。
④将“仅器A”插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生。
回答下列问题:
a.为什么在“②往烧杯中注入水,直至水面没过调斗颈”这一步中改加水为加酸会得0分:______________________________________________________________________________。
b.“仪器A”可以是________________________。
c.合金样品用铜网包裹的目的是____________________________________。
相关试题

