
【题目】下表是元素周期表中的前四周期,回答下列问题:
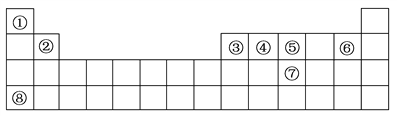
(1)按原子轨道的重叠方式,①与⑤形成的化合物中的共价键属于________(填“σ”或“π”)键。
(2)②、⑤、⑥、⑧四种元素第一电离能由高到低的顺序是________(用元素符号表示)。
(3)元素④形成的单质的晶体类型可以是原子晶体,如________(填写物质名称),也可以是________,如C60。
(4)元素③、⑥形成的化合物与⑦的氢化物均为AB3型,但这两种化合物分子的立体结构明显不同。③、⑥两种元素形成的化合物分子的立体结构为________,⑦的氢化物分子的立体结构为________。
【答案】 σ F、N、Be、K 金刚石 分子晶体 平面三角形 三角锥形
【解析】由元素在周期表中位置,可知①为H、②为Be、③为B、④为C、⑤为N、⑥为F、⑦为P、⑧为K。(1)按原子轨道的重叠方式,①与⑤形成的化合物NH3中是氮氢单键,按原子轨道的重叠方式共价键分为σ键、π键,单键为σ键;(2)同周期自左而右,第一电离能呈增大趋势,K的4s能级容纳1个电子,容易失去,能量较高,第一电离能最低,故第一电离能:F>N>Be>K;(3)元素④为碳元素,形成的单质的晶体类型可以是原子晶体,如金刚石,也可以是分子晶体,如C60;(4)元素③、⑥形成的化合物BF3与⑦的氢化物PH3均为AB3型,但这两种化合物分子的立体结构明显不同。BF3分子的立体结构为平面三角形,PH3分子的立体结构为三角锥形。


科目:高中化学 来源: 题型:
【题目】将一定质量Mg、Zn、Al的混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),则原混合物的质量不可能是( )
A.2g B.4g C.6g D.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~R九种元素在周期表的位置:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式____________。
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是_________________ (填化学式)
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为 __________________(用元素的离子符号表示)
(4)写出A的单质与水反应的化学方程式____________________
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g。X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应。
X的元符号是_______________,它位于元素周期表中______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:

(1)镓的基态原子的电子排布式是_____________________________________。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为________,与同一个镓原子相连的砷原子构成的立体构型为________。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是________。(用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为________。
(5)比较二者的第一电离能:As________Ga(填“<”“>”或“=”)。
(6)下列说法正确的是________。
A.砷化镓晶胞结构与NaCl相同
B.GaP与GaAs互为等电子体
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以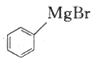 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com