【题目】化学和环境保护、食品营养、材料应用等密切相关。
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是______(填字母)。
a.二氧化碳的浓度 b.二氧化硫的浓度 c.可吸入颗粒物的浓度
②下列做法中不利于改善环境质量的是________(填字母)。
a.将废旧电池进行深埋处理
b.充分利用风能等新能源
c.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是______(填字母)。
a.氧化还原法 b.中和法 c.沉淀法
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是______(填元素符号)。
②下列物质中,具有抗菌消炎疗效的是________(填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是________,属于着色剂的是__________,属于防腐剂的是________。

(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①水泥、玻璃及陶瓷都是传统的硅酸盐材料,生产水泥和玻璃都用到的原料是________;蓝色玻璃是在其中添加了氧化物________(写化学式);SiC是一种新型的陶瓷,工业上用石英砂与焦炭高温条件下生成SiC的同时的生成CO,该制备反应的化学方程式为_____________。
②钢铁制品在潮湿的空气中发生______(填“化学”或“电化学”)腐蚀是造成钢铁腐蚀的主要原因。硬铝(一种铝合金)是制造飞机和宇宙飞船的理想材料,和纯铝相比,硬铝强度________________(填“低”“高”或“无法确定”),具有较强的抗腐蚀能力。
③橡胶是制造轮胎的重要原料,天然橡胶通过________(填“硫化”“氧化”或“老化”)措施可增大其强度、弹性和化学稳定性等。
参考答案:
【答案】a a b 铁 c 鸡肉粉 姜黄 苯甲酸钠 石灰石 Co2O3 SiO2+3C![]() SiC+2CO↑ 电化学 高 硫化
SiC+2CO↑ 电化学 高 硫化
【解析】
(1)①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,CO2是空气的成分,不包括在大气污染范围内,故合理选项是a;
②a.废旧电池中含有重金属,进行深埋处理 能污染水资源和土壤,应回收处理,a符合题意;
b.充分利用风能等清洁能源,减少了化石燃料的使用,有利于改善环境质量,b不符合题意;
c.给汽车加装尾气催化净化装置,减少了污染物一氧化碳和一氧化氮的排放,有利于改善环境质量,c不符合题意;
故合理选项是a;
③废水中含有盐酸等酸性物质,盐酸易溶于水,水溶液呈酸性,所以要在废水中加入碱性物质,使其发生酸碱中和反应而降低废水的酸性,故采用的处理方法是中和法,合理选项是b;
(2)①在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是铁元素,故合理填项是Fe;
②氨基酸不是药,阿斯匹林具有解热镇痛作用,青霉素是消炎药,故合理选项是c;
③根据鸡肉粉中含有蛋白质,蛋白质水解生成氨基酸,姜黄是着色剂;苯甲酸钠是防腐剂;
(3)①生产玻璃的原料是纯碱、石灰石和石英;生产水泥以黏土和石灰石为主要原料,所以在玻璃工业、水泥工业中都用到的原料是石灰石即碳酸钙;
②钢铁制品含有铁及杂质碳等,在潮湿的环境下容易形成原电池,发生电化学腐蚀;硬铝是合金,其强度比一般成分金属高;
③天然纤维是人从自然界的植物或动物身上直接获得的纤维;天然橡胶通过硫化措施可增大强度和弹性。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水
 NaClO3
NaClO3 NaClO4
NaClO4 NaClO4
NaClO4 NH4ClO4
NH4ClO4下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置_________
(2)F元素的最高价氧化物对应的水化物的化学式为________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________(用离子符号表示)。
(4)写出化合物D2C2的电子式:________。
(5)E、F的简单离子的还原性大小顺序为:_________。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
-
科目: 来源: 题型:
查看答案和解析>>【题目】印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:
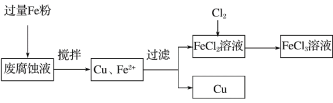
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是________(填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为__________________________________。
(3)如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。

实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是__________________________________。
(4)按上述流程操作,需称取Fe粉的质量应不少于________ g(精确到0.1 g),需通入Cl2的体积不少于________ L(标况)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L—1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A. 60 mLB. 50 mLC. 30 mLD. 15 mL
-
科目: 来源: 题型:
查看答案和解析>>【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、SO32-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )

A.该溶液X中可能有Fe3+、Na+
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有NH4+
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在SO42-、SO32-中的某一种
相关试题

