【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。 请回答下列问题:
(1)滴定前,用移液管量取待测NaOH溶液于 _____中( 填仪器名称),并加入2~3滴指示剂;
(2)盛装标准盐酸的仪器名称为 _____ ;
(3)如何判断滴定终点(需写出颜色变化) __________ ;
某学生做了三组平行实验,数据记录如下:
(4)选取下述合理数据,算出待测NaOH溶液的物质的量浓度为 ___________;(保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/ mL | 0.1000mol.L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(5)下列哪些操作会使测定结果偏低____________。
a.反应容器用蒸馏水洗净后,未用待测液润洗
b.滴定前,平视读数;滴定后,仰视读数
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡
【答案】锥形瓶 酸式滴定管 溶液由黄色变为橙色且半分钟内不褪色 0.1052mol/L c
【解析】
(1)滴定操作标准液在滴定管中,待测液盛在锥形瓶中;
(2)酸性溶液存放在酸式滴定管中;
(3)根据滴定终点时溶液颜色由黄色突变为橙色,且保持半分钟不变色;
(4)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出c(NaOH);
(5)根据c(待测)=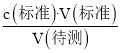 分析不当操作对V(标准)的影响,以此来解答。
分析不当操作对V(标准)的影响,以此来解答。
(1)NaOH为待测液,用碱式滴定管取待测NaOH溶液于锥形瓶中;
(2)盛装标准盐酸的仪器名称为酸式滴定管;
(3)待测液是氢氧化钠,锥形瓶中盛有的氢氧化钠溶液中滴入甲基橙,根据指示剂的变色范围可知:溶液的颜色是黄色,随着溶液的pH减小,当滴到溶液的pH小于4.4时,溶液颜色由黄色变成橙色,且半分钟不褪色,滴到结束,故滴定终点的现象为:溶液由黄色变为橙色且半分钟内不褪色;
(4)根据数据的有效性,舍去第2组数据,则1、3组平均消耗V(盐酸)=![]() =26.30mL,由HCl+NaOH═NaCl+H2O可知:0.0263L×0.1000mol/L=0.025L×c(NaOH),解得c(NaOH)=0.1052mol/L;
=26.30mL,由HCl+NaOH═NaCl+H2O可知:0.0263L×0.1000mol/L=0.025L×c(NaOH),解得c(NaOH)=0.1052mol/L;
(5) a.反应容器用蒸馏水洗净后,未用待测液润洗,由于待测碱溶液中溶质的物质的量不变,因此对所测溶液的浓度无影响,a不符合题意;
b.滴定前,平视读数;滴定后,仰视读数,则消耗标准酸溶液体积偏大,根据c(待测)=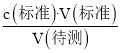 可知:V(标准)偏大,则会导致c(待测)偏大,b不符合题意;
可知:V(标准)偏大,则会导致c(待测)偏大,b不符合题意;
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡,则消耗标准酸溶液体积偏低,根据c(待测)=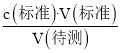 可知:V(标准)偏低,则会导致c(待测)偏低,c符合题意;
可知:V(标准)偏低,则会导致c(待测)偏低,c符合题意;
故合理选项是c。

