【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)2NO2(g)△H,上述反应分两步完成,其反应历程如图1所示, 回答下列问题:
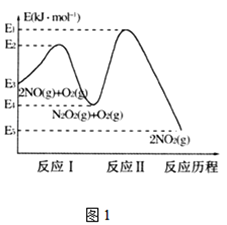
①写出反应I的热化学方程式________________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)![]() N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。
N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
②计算反应达到第一次平衡时的平衡常数K=____________。
③第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
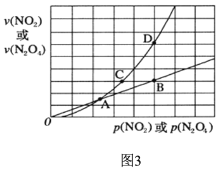
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
【答案】2NO(g) = N2O2(g) △H=(E4-E3) kJ·mol1 反应Ⅱ 温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢 α1 20% 0.675 C B、D 达到平衡时,N2O4与NO2的消耗速率满足条件υ(NO2) = 2(N2O4)
【解析】
(1)①反应热焓变等于生成物总能量减去反应物总能量,因此反应I的热化学方程式2NO(g) = N2O2(g) △H=(E4-E3) kJ·mol1;故答案为:2NO(g) = N2O2(g) △H=(E4-E3) kJ·mol1。
②反应I和反应Ⅱ中,反应Ⅱ所需活化能大,反应速率慢,慢反应决定反应体系速率,因此决定2NO(g) + O2(g) ![]() 2NO2(g)反应速率的是反应Ⅱ;对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;故答案为:反应Ⅱ;温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢。
2NO2(g)反应速率的是反应Ⅱ;对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;故答案为:反应Ⅱ;温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢。
(2)①0~10min,1020 min,3040 min三个阶段NO2的转化率分别为![]() 、
、![]() 、
、![]() ,其中最小的为α1,其值是20%。
,其中最小的为α1,其值是20%。
②根据图中信息计算反应达到第一次平衡时的平衡常数![]() ;故答案为:0.675。
;故答案为:0.675。
③根据图中信息,第10min时,反应速率加快,若只改变了影响反应的一个条件,A.增加C(s)的量,速率不变,故A不符合题意;B.减小容器体积,浓度瞬间增大,但图中信息浓度没有变化,故B不符合题意;C.加入催化剂,速率加快,故C符合题意;综上所述,答案为C。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,根据图3标出点信息,当达到平衡时,υ(NO2) = 2(N2O4),则BD两点满足;故答案为:B、D;达到平衡时,N2O4与NO2的消耗速率满足条件υ(NO2) = 2(N2O4)。
N2O4(g) △H<0,根据图3标出点信息,当达到平衡时,υ(NO2) = 2(N2O4),则BD两点满足;故答案为:B、D;达到平衡时,N2O4与NO2的消耗速率满足条件υ(NO2) = 2(N2O4)。

