【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)Y在元素周期表中的位置是___。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是___。
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为___。
(4)元素X的金属性比元素Y___(填“强”或“弱”),用原子结构的知识解释原因___。
(5)元素Q、元素Z的含量影响钢铁性能,采用如图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
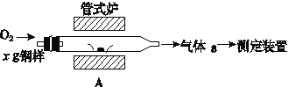
①气体a的成分是__(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是___。
【答案】第三周期第IIIA族 CH2=CH2+H2O![]() CH3CH2OH 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 强 镁和铝在同一周期,从左到右,原子半径减小,失电子能力减弱,金属性减弱 O2,SO2,CO2 5O2+3FeS
CH3CH2OH 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 强 镁和铝在同一周期,从左到右,原子半径减小,失电子能力减弱,金属性减弱 O2,SO2,CO2 5O2+3FeS![]() 3SO2+Fe3O4
3SO2+Fe3O4
【解析】
Z的化合价为+6、-2,则其为硫(S)元素,从主要化合价及原子半径数值,可确定X为Mg、Y为Al;参照化合价及与Z的半径比较,可确定M为氮(N)、Q为碳(C);最后确定R为氢(H)。从而得出X、Y、Z、M、Q、R分别为Mg、Al、S、N、C、H。
(1)Y为硫,可通过书写原子结构示意图,确定其在元素周期表中的位置。
(2) A是果实催熟剂,则其为乙烯,乙烯与水发生加成反应可制得乙醇。
(3)单质铜与稀硝酸反应,生成Cu(NO3)2、NO、H2O。
(4)Mg与Al的金属性比较,可利用同周期元素的性质递变规律进行分析。
(5)钢样中的元素碳、硫在装置A中转化为CO2、SO2。
①气体a的成分中,除含两种氧化物外,还应含有过量的氧气。
②铁的氧化物中,稳定的黑色氧化物为四氧化三铁。FeS与O2反应,生成SO2和Fe3O4。
由分析知,X、Y、Z、M、Q、R分别为Mg、Al、S、N、C、H。
(1)Y为硫,可通过书写原子结构示意图,确定其在元素周期表中的位置是第三周期第IIIA族。答案为:第三周期第IIIA族;
(2) A是果实催熟剂,则其为乙烯,乙烯与水反应生成乙醇,化学方程式为CH2=CH2+H2O![]() CH3CH2OH。答案为:CH2=CH2+H2O
CH3CH2OH。答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(3)单质铜与稀硝酸反应,生成Cu(NO3)2、NO、H2O,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)Mg与Al在元素周期表中位于第三周期,且镁在铝的左边,同周期元素,从左到右,原子半径减小,失电子能力减弱,金属性减弱。答案为:从左到右,原子半径减小,失电子能力减弱,金属性减弱;
(5)钢样中的元素碳、硫在装置A中转化为CO2、SO2。
①气体a中,除含两种氧化物外,还应含有过量的氧气,则气体a的成分为O2,SO2,CO2。答案为:O2,SO2,CO2;
②FeS与O2反应,生成SO2和四氧化三铁,反应的化学方程式为5O2+3FeS![]() 3SO2+Fe3O4。答案为:5O2+3FeS
3SO2+Fe3O4。答案为:5O2+3FeS![]() 3SO2+Fe3O4。
3SO2+Fe3O4。

