【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
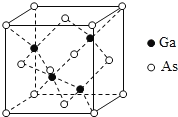
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
【答案】)![]() 1 +1 大 3:2 三角锥形 sp3 共价
1 +1 大 3:2 三角锥形 sp3 共价 ![]() ×100%
×100%
【解析】
(1)As为33号元素,基态As原子的核外价电子为其4s能级上2个电子、4p能级上3个电子,基态Ga原子核外4p能级上有1个电子;
(2)根据电离能知,失去1个或3个电子时电离能发生突变,由此可推知镓的主要化合价,同一周期元素电负性随着原子序数增大而增大;
(3)共价单键为σ键、共价三键中含有一个σ键、两个π键;根据价层电子对个数=σ键个数+孤电子对个数计算结合价层电子对互斥理论判断空间构型;
(4)根据价层电子对互斥理论判断C原子杂化类型;
(5)根据GaAs为原子晶体判断Ga和As原子之间的作用力;根据均摊法计算该晶胞中Ga、As原子个数,计算晶胞的质量和体积,再根据晶胞中原子的体积占晶胞体积的百分率=![]() ×100%计算。
×100%计算。
(1)基态As原子的核外价电子为其4s能级上2个电子、4p能级上3个电子,所以其价电子排布式为 ,基态Ga原子核外4p能级上有1个电子,则Ga未成对电子数是1,故答案为:
,基态Ga原子核外4p能级上有1个电子,则Ga未成对电子数是1,故答案为: ;1;
;1;
(2)根据镓失去电子的逐级电离能知,失去1个或3个电子电离能突变,由此可推知镓的主要化合价为+1和+3,同一周期元素电负性随着原子序数增大而增大,二者位于同一周期且原子序数Ga<As,则电负性As比Ga大,故答案为:+1;大;
(3)共价单键为σ键、共价三键中含有一个σ键、两个π键,因此乙炔分子中含有3个σ键、2个π键,则σ键、π键个数之比为3∶2;AsCl3分子中As原子价层电子对个数=3+![]() =4,含有一个孤电子对,根据价层电子对互斥理论判断空间构型为三角锥形,故答案为:3∶2;三角锥形;
=4,含有一个孤电子对,根据价层电子对互斥理论判断空间构型为三角锥形,故答案为:3∶2;三角锥形;
(4)(CH3)3Ga中碳原子价层电子对个数是4,根据价层电子对互斥理论判断C原子杂化类型为sp3,故答案为:sp3;
(5)GaAs为原子晶体,Ga和As原子之间以共价键键合;该晶胞中Ga原子个数是4、As原子个数=8×![]() +6×
+6×![]() =4,所以其化学式为GaAs,该晶胞体积=
=4,所以其化学式为GaAs,该晶胞体积=![]() =
=![]() cm3,该晶胞中所有原子体积=4×
cm3,该晶胞中所有原子体积=4×![]() π[(a×10-10)3+(b×10-10)3]cm3=4×
π[(a×10-10)3+(b×10-10)3]cm3=4×![]() π×10-30×(a3+b3)cm3,GaAs晶胞中原子的体积占晶胞体积的百分率=
π×10-30×(a3+b3)cm3,GaAs晶胞中原子的体积占晶胞体积的百分率= ×100%=
×100%=![]() ×100%,故答案为:共价;
×100%,故答案为:共价; ![]() ×100%。
×100%。

