【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
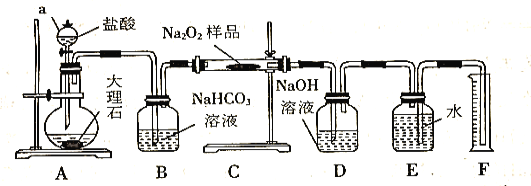
①装置D的作用是_________________________________;
②将仪器连接好以后,必须进行的第一步操作是_________________________________;
③写出装置C中发生主要反应的化学方程式_________________________________;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是_______________(填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________________________。
【答案】BaCl2 吸收氧气中混有的二氧化碳气体 检查装置气密性 2Na2O2 + 2CO2 =2Na2CO3 + O2 abc 39V/56m%
【解析】
(1)过氧化钠在空气中变质会生成碳酸钠固体,依据碳酸根离子检验是否变质;
(2)①二氧化碳和过氧化钠反应生成的氧气,可能会有过量的二氧化碳干扰氧气体积的测定,因此需用装置D吸收氧气中混有的二氧化碳气体,
故答案为:吸收氧气中混有的二氧化碳气体;
②依据装置图分析可知,测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置必须气密性良好;
③装置C中是二氧化碳和过氧化钠反应生成碳酸钠和氧气;
④依据量筒读取液体体积时需要和集气瓶液面相平,温度在常温下;
⑤依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠的物质的量,得到过氧化钠的质量分数;
(1)过氧化钠在空气中变质会生成碳酸钠固体,探究一包过氧化钠样品是否已经变质,可以利用碳酸根离子和钡离子结合生成碳酸钡白色沉淀证明Na2O2已经变质,
故答案为:BaCl2溶液;
(2)①二氧化碳和过氧化钠反应生成氧气,可能会有过量的二氧化碳干扰氧气体积的测定,因此需用装置D吸收氧气中混有的二氧化碳气体,
故答案为:吸收氧气中混有的二氧化碳气体;
②实验探究测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置必须气密性良好,将仪器连接好以后,必须进行的第一步操作是检查装置的气密性;
故答案为:检查装置的气密性;
③装置C中发生的是二氧化碳和过氧化钠生成碳酸钠和氧气的反应,反应的化学方程式为:2Na2O2 + 2CO2 =2Na2CO3 + O2;
故答案为:2Na2O2 + 2CO2 =2Na2CO3 + O2;
④a. 直接读取气体体积,不冷却到室温,会使溶液体积增大,读出结果产生误差,故a项正确;
b. 调整量筒内外液面高度使之相同,使装置内压强和外界压强相同,避免读取体积产生误差,故b项正确;
c. 视线与凹液面的最低点相平读取量筒中水的体积是正确的读取方法,故c项正确;
故答案为:abc;
⑤测定出量筒内水的体积后,折算成标准状况下氧气的体积为V mL其物质的量=![]() ,根据化学方程式2Na2O2 + 2CO2 =2Na2CO3 + O2可知样品中过氧化钠的物质的量为
,根据化学方程式2Na2O2 + 2CO2 =2Na2CO3 + O2可知样品中过氧化钠的物质的量为![]() ×2 mol,则其质量分数为=
×2 mol,则其质量分数为=![]() ×100% = 39V/56m%;
×100% = 39V/56m%;
故答案为:39V/56m%;

