【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
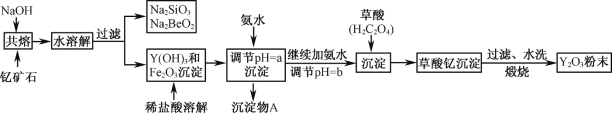
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 | |
Y3+ | 6.0 | 8.2 | |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在 范围内;继续加氨水调节pH =b发生反应的离子方程式为 ;检验Fe3+是否沉淀完全的操作方法是 。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式 。
【答案】(14分)
(1)①B(2分) ②BeO![]() +4H+===Be2++2H2O(2分)
+4H+===Be2++2H2O(2分)
(2)3.7~6.0(2分) Y3++3NH3·H2O=Y(OH)3↓+3NH4+(2分)
取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若观察不到血红色,则说明Fe3+沉淀完全(3分)
(3)Y2(C2O4)3.nH2O![]() Y2O3+3CO↑+3CO2↑+ nH2O(3分)
Y2O3+3CO↑+3CO2↑+ nH2O(3分)
【解析】
试题分析:(1)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,所以Na2BeO2的性质和NaAlO2类比推断;加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子,故答案为B;
②Na2BeO2与足量盐酸发生反应生成氯化铍氯化钠和水,反应的离子方程式为:BeO22-+4H+=Be2++2H2O;
(2)三价铁离子开始沉淀到沉淀完全的PH范围为:2.7-3.7;钇离子开始沉淀和沉淀完全的PH为:6.0-8.2;所以使Fe3+沉淀完全,须用氨水调节pH=a,3.7<a<6.0;继续加氨水调节pH=b发生反应的离子方程式为:Y3++3NH3H2O=Y(OH)3↓+3NH4+;检验三价铁离子是否沉淀需要检验滤液中是否含有三价铁离子,结合三价铁离子检验试剂是硫氰酸钾溶液变血红色;取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀;
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊,说明有CO2气体产物,草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式为Y2(C2O4)3.nH2O![]() Y2O3+3CO↑+3CO2↑+ nH2O。
Y2O3+3CO↑+3CO2↑+ nH2O。

