【题目】太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。

(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
参考答案:
【答案】(1)1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)4; (3)F的电负性比N大,N—F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(合理答案均计分)
(4)4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(5)sp3;孤电子对; (6)分子间作用力;![]() ;
;
【解析】
试题分析:(1)Cu是29号元素,其原子核外有29个电子,1s22s22p63s23p63d104s1,二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定;(2)8个顶点8个氧,利用率1/8;4条棱上4个氧,利用率1/4;上下两面2个氧,利用率1/2;中心还有1个氧;所以总共为4.(3) F的电负性比N大,N—F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;(4)(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C﹣S﹣S﹣C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸。(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,根据价层电子对互斥理论确定B原子的杂化方式为sp3;B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对。(6)结构与石墨晶体相似,层间相互作用为分子间作用力;晶胞体积=(361.5×10﹣10cm)3,而每个晶胞中每个N原子被4个B原子共用、每个B原子被4个N原子共用,所以密度为4x(14+11)/ (361.5×10﹣10cm)3NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列分子或离子在无色透明的溶液中能大量共存的是( )
A. Na+、H+、CO32-、H2O2 B. Ca2+、NO3-、OH-、HCO3-
C. Na+、OH-、Cl-、NH3·H2O D. Na+、Fe3+、SO42-、Cl-
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验中,所采取的分离方法不正确的是( )
选项
目的
分离方法
A
除去铜器表面的铜绿[Cu2(OH)2CO3]
用盐酸浸泡,再用清水冲洗
B
除去乙醇中的少量水
加生石灰,再蒸馏
C
除去氯化铁中含有少量氯化亚铁杂质
加入溴水
D
除去NaCl固体中的NH4Cl
加热
A.A
B.B
C.C
D.D -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法可以证明可逆反应N2+3H2
 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是①一个N≡N键断裂的同时,有6个N-H键断裂
②v(H2)=0.6 mol·L-1·min-1,v(NH3)=0.4 mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体质量保持不变
A. ②③④ B. ①③④ C. ①②④ D. ③④⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):

(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O
 NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中正确的一组是
A. H2和D2互为同素异形体
B.
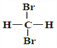 和
和 互为同分异构体
互为同分异构体C.
 和
和 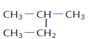 是同一种物质
是同一种物质D. 正丁烷和异丁烷互为同系物
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O
 H3O++CO32-
H3O++CO32-B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. 碳酸钙的溶解平衡:CaCO3(s)
 Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)D. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
相关试题

