【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
参考答案:
【答案】 H2A=2H++A2- C c(NH4+)>c(A2-)>c(H+)>c(OH-) c(NO2- )>c(NH4+)>c(H+ )>c(OH-) ![]() 正 2CO2+12H++12e-=C2H4+4H2O
正 2CO2+12H++12e-=C2H4+4H2O
【解析】(1)99 ℃时,水的离子积常数Kw=1.0×10-12,=c2(H+),c(H+)=![]() =1.0×10-6,中性时pH=6。该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,Na2A是强酸强碱盐。①H2A是强酸,在水溶液中的电离方程式为 H2A=2H++A2- ,②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,n(H+)=c(H+)×V,氢离子浓度和体积相同,产生的氢气相同,故选C。③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,生成(NH4)2A,在水中电离成NH4+、A2-, NH4+水解使溶液呈酸性,溶液中各离子浓度从大到小的顺序为c(NH4+)>c(A2-)>c(H+)>c(OH-);(3)① 乙烯碳与碳形成双键,电子式为
=1.0×10-6,中性时pH=6。该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,Na2A是强酸强碱盐。①H2A是强酸,在水溶液中的电离方程式为 H2A=2H++A2- ,②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,n(H+)=c(H+)×V,氢离子浓度和体积相同,产生的氢气相同,故选C。③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,生成(NH4)2A,在水中电离成NH4+、A2-, NH4+水解使溶液呈酸性,溶液中各离子浓度从大到小的顺序为c(NH4+)>c(A2-)>c(H+)>c(OH-);(3)① 乙烯碳与碳形成双键,电子式为![]() ;②b电极上水失去电子产生氧气,故b电极名称是正极;③电解时生成乙烯的电极反应式2CO2+12H++12e-=C2H4+4H2O。
;②b电极上水失去电子产生氧气,故b电极名称是正极;③电解时生成乙烯的电极反应式2CO2+12H++12e-=C2H4+4H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知某物质X能发生如下转化:

下列有关上述转化关系中物质及其反应的叙述错误的是( )
A. 若X为N2或NH3,则A为硝酸
B. 若X为S或H2S,则A为硫酸
C. 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D. 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列几种物质的保存方法中不正确的是
A.碘易升华,可保存在酒精中
B.少量金属钠保存在煤油中
C.氯水通常保存在棕色细口瓶并置于阴凉处
D.在盛液溴的试剂瓶中加水,形成“水封”,以减少溴的挥发
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)
 CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:物质
CO
H2
CH3OH
物质的量(mol)
1.8
2.0
1.2
①反应达到平衡时,CO的转化率为_______,5分钟内用H2表示的速率为________
②该反应的平衡常数K=__________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CO、H2的浓度之比为1:2
E.单位时间内,每生成1mol H2消耗2mol CH3OH
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正 __________v逆(填“ >” < ”或“= ”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】合金是金属与一些非金属或其他金属在熔化状态下形成的一种熔合物,根据下表中提供的数据,判断可以形成合金的是( )
金属或非金属
钠
铝
铁
硅
硫
熔点/℃
97.8
660.4
1535
1410
112.8
沸点/℃
886
2467
2750
2353
444.6
A.铝与硫B.铝与硅C.钠与铁D.钠与硅
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列所给的化学反应中,不属于氧化还原反应的是
A. CaCO3+2HCl = CaCl2+CO2↑+H2O
B. Fe+CuSO4 =Cu+FeSO4
C. Fe2O3+3CO
 2Fe+3CO2↑
2Fe+3CO2↑D. 2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,在镁屑和无水乙醚的混合体系中,滴加卤代烷,反应后得到的有机镁化合物称为格氏试剂。制备的格氏试剂不需要分离就可直接用于有机合成,是重要的有机合成中间体。反应原理为:
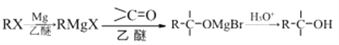
利用A(
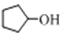 )来合成
)来合成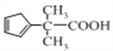 的流程如图所示:
的流程如图所示:
(1)物质A的名称为________;
(2)A
 B的反应类型是_________;
B的反应类型是_________;(3)写出由F生成G、G生成H的化学方程式:_____________________________;
(4)D的同分异构体中含有六元环且能发生银镜反应的有___________种;
(5)写出符合下列要求的I的同分异构体的结构简式_________;(写一种即可,已知同一个碳原子上不能连接2个羟基)
①芳香族化合物 ②二元醇 ③分子中有5种不同化学环境的H原子
相关试题

