
【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为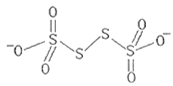 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
【答案】[Ar]3d104s24p4或1s22s22p63s23p63d104s24p4 NH3分子与H2O分子之间可以形成氢键,而H2S分子不能与H2O分子之间形成氢键 OF2 1:1 sp3杂化 由于电负性N>P>H,且氮原子半径小于磷原子半径,NH3分子中成键电子对彼此相距更近,斥力更大,所以键角NH3>PH3 4 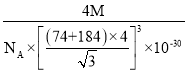
【解析】
(1)元素Se处于第四周期VIA族,原子序数为34;NH3分子与H2O分子间形成氢键,H2S不能与H2O形成氢键;
(2)等电子体是指原子数目相等,价电子数目相等的粒子,利用原子替换书写,同主族元素原子价电子数目相等;
(3)![]() 的结构中两边的S原子均形成4个σ键且无孤对电子,中间的两个S原子均形成两个单键,且均有两对孤对电子;
的结构中两边的S原子均形成4个σ键且无孤对电子,中间的两个S原子均形成两个单键,且均有两对孤对电子;
(4)电负性N>P,且N原子半径小于P原子半径,NH3中成键电子对彼此相离更近,斥力更大;
(5)根据74÷184≈0.402,离子晶体RA的晶胞为立方ZnS型,晶胞中阴离子的配位数为4,晶胞中阴阳离子个数比为1:1.1个晶胞含有4个“RA”,结合摩尔质量计算晶胞中微粒总质量,阴阳离子半径之和为体对角线的![]() ,且体对角线为晶胞边长的
,且体对角线为晶胞边长的![]() 倍,结合密度公式计算
倍,结合密度公式计算
(1)元素Se处于第四周期VIA族,原子序数为34,基态电子排布为1s22s22p63s23p63d104s24p4;N的电负性很大,使得NH3中N-H键极性非常强,N原子带有明显的负电荷,H2O强极性O-H中的H几乎成为裸露的质子,NH3分子与H2O分子间形成了O-H…N氢键,使NH3在水有很大的溶解度。H2S中S所带负电荷不足以使H2S与H2O形成氢键,所以H2S在水中溶解度较小,故答案为:[Ar]3d104s24p4或1s22s22p63s23p63d104s24p4;NH3分子与H2O分子之间可以形成氢键,而H2S分子不能与H2O分子之间形成氢键;
(2)等电子体是指原子数目相等,价电子数目相等的粒子,由1~9号元素中的部分元素组成的物质中,与SCl2互为等电子体的共价化合物,只有OF2;SCN-与CO2互为等电子体,CO2的分子结构为O=C=O,其中σ键和π键的个数比为2:2=1:1,所以SCN-中σ键和π键的个数比为也1:1,故答案为:OF2;1:1;
(3)![]() 的结构中两边的S原子均形成4个σ键且无孤对电子,所以均为sp3杂化,中间的两个S原子均形成两个单键,且均有两对孤对电子,所以均为sp3杂化,故答案为:sp3杂化;
的结构中两边的S原子均形成4个σ键且无孤对电子,所以均为sp3杂化,中间的两个S原子均形成两个单键,且均有两对孤对电子,所以均为sp3杂化,故答案为:sp3杂化;
(4)NH3和PH3均是三角锥形结构,都有一对孤对电子的斥力影响,由于电负性N>P>H,且N原子半径小于P原子半径,NH3中成键电子对彼此相离更近,斥力更大,所以键角NH3>PH3,故答案为:由于电负性N>P>H,且氮原子半径小于磷原子半径,NH3分子中成键电子对彼此相距更近,斥力更大,所以键角NH3>PH3;
(5)根据74÷184≈0.402,离子晶体RA的晶胞为立方ZnS型,晶胞中可以看出阴离子的配位数为4,由于阴阳离子个数比为1:1,所以阳离子的配位数为4。1个晶胞含有4个“RA”,晶胞中微粒总质量=![]() ,阴阳离子半径之和为体对角线的
,阴阳离子半径之和为体对角线的![]() ,且体对角线为晶胞边长的
,且体对角线为晶胞边长的![]() 倍,则晶体密度=
倍,则晶体密度=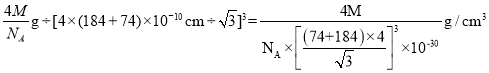 ,故答案为:4;
,故答案为:4;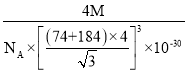 。
。


科目:高中化学 来源: 题型:
【题目】关于下列两个实验的说法正确的是( )
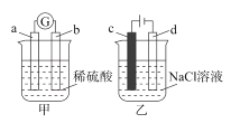
A.若甲中b电极的表面有气泡产生,则b为阳极
B.若甲中a为Zn,b为Cu,则正极附近的SO![]() 离子浓度逐渐增大
离子浓度逐渐增大
C.若乙中c电极为Fe,则电解一段时间后,溶液变浑浊
D.若乙中c、d均为惰性电极,产生22.4LCl2时,则转移电子2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2mol/LNH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O)
),c(H2CO3)>c(NH3H2O)
B.0.2mol/L氨水:0.2mol/L>c(OH-)+ c(NH3H2O)
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2的盐酸与pH=12的氨水等体积混合:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图,下列关于分枝酸的叙述正确的是
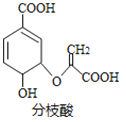
A.分子中含有5种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到预期目的的是
实验方案 | 实验目的 | |
A | 向两支试管中分别加入 | 探究 |
B | 取 | 配制8%的 |
C | 将 | 比较 |
D | 测同温同浓度 | 比较硫和硅两元素非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )

A. 1∶4∶2 B. 3∶9∶4
C. 2∶9∶4 D. 3∶8∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂结构如图所示,其中W.Y.Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是
![]()
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X、Y形成的化合物热还原制备单质Y
D.该漂白剂中仅有X均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com