【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
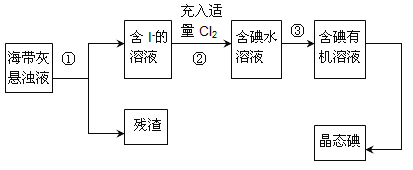
(1)指出提取碘的过程中有关的实验操作名称:①________,③________;
(2)操作③中所用的有机试剂可以是________;
A.乙醇 B.四氯化碳 C.乙酸 D.汽油
(3)已知操作步骤②中得到的“含碘水溶液中有Cl-离子存在,写出该步骤的离子反应:___________________________________________;
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出仪器N的名称是:________________________,装置中有典型两处错误,加以改正:①________________________,②_______________________________。
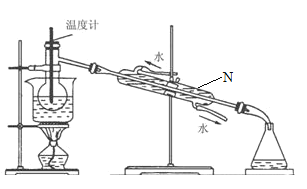
【答案】过滤 萃取、分液 BD 2I-+Cl2=I2+2Cl- 冷凝管 温度计的位置应将水银球置于蒸馏烧瓶支管口处 冷凝水应下进上出
【解析】
以海带为原料获得少量碘单质:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘化钾的溶液,向水溶液中通入足量Cl2,发生反应为2I-+Cl2=2Cl-+I2,向含有碘单质的溶液中加入萃取剂四氯化碳萃取,然后蒸馏得到碘单质。
(1) 将溶液和不溶性固体分离的方法是过滤,从碘水中获取碘的有机溶液采用萃取、分液的方法;
(2) 操作③为萃取、分液,选择的萃取剂不溶于水,且碘在其中溶解度比水中大,因乙醇、乙酸易溶于水不能作为萃取剂,则应选择四氯化碳和汽油,故答案为BD;
(3) 步骤②中得到的含碘水溶液中有Cl-离子,说明通入Cl2氧化I-,则发生反应的离子反应方程式为2I-+Cl2=I2+2Cl-;
(4)蒸馏装置中仪器N的名称是冷凝管,由图可知,装置中有典型两处错误,分别是温度计水银球应与烧瓶支管口相平测蒸汽温度,冷却水应下进上出与热气体对流,提高冷却效果。

