【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
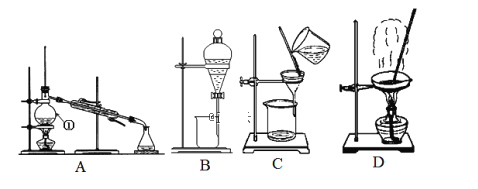
Ⅰ.(1)从碘水中分离出I2,选择装置_______,该分离方法的名称为_________。
(2)写出上图中仪器①的名称___________________ ;
(3)冷凝管中冷却水的方向为________________________ 。
Ⅱ.实验室要配制2mol/L稀硫酸240mL。
(1)量取18.4mol/L的浓硫酸时,用下面那种规格的量筒___(填序号)
①10mL ②50mL ③100mL ④500mL
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有玻璃棒、胶头滴管、________。
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处______;
Ⅲ.200mL 5mol/L NaOH溶液中,取出20mL溶液,其溶质的质量是___________;将取出的溶液稀释至100mL,其溶质的物质的量浓度是_____________。
【答案】B 萃取 蒸馏烧瓶 下进上出 ② 250 mL容量瓶 偏高 偏低 4g 1 mol/L
【解析】
(1)从碘水中分离出I2,选择用萃取分液的方法,使用分液漏斗,故选B;
(2)仪器①的名称为蒸馏烧瓶;
(3)冷凝管中冷却水按下进上出的方式;
Ⅱ.(1)配制2mol/L稀硫酸240mL,应该用250mL容量瓶,需要18.4mol/L的浓硫酸的体积为![]() ,故选择50mL的量筒,故选②;
,故选择50mL的量筒,故选②;
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有玻璃棒、胶头滴管、 250 mL容量瓶;
(3)①用量筒量取浓硫酸时,仰视量筒进行读数,则浓硫酸的体积变大,则浓度偏高;
②定容时,液面超过刻度线后用胶头滴管吸至液面处,溶质有损失,故浓度偏低;
Ⅲ. 200mL 5mol/L NaOH溶液中,取出20mL溶液,其溶质的质量为0.02L×5mol/L×40g/mol=4g;将取出的溶液稀释至100mL,其溶质的物质的量浓度是![]() =1 mol/L。
=1 mol/L。

