【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去)。
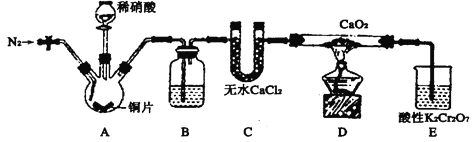
已知:2NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2。
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因为(用方程式表示)_________。
(2)装置B所加试剂是__________,作用是除去__________(填化学式)。
(3)装置E中,酸性K2Cr2O7溶液可将剩余的NO氧化成![]() ,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是__________。
,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是__________。
(4)已知:Ca(NO2)2溶液遇酸会产生NO气体。设计实验证明装置D中有亚硝酸钙生成:_________。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO+NO2=Ca(NO2)2+H2O。
①若n(NO) :n(NO2)>1 :1,则会导致_______________;
②若n(NO) :n(NO2)<1 :1,则会导致________________。
【答案】2NO+O2=2NO2 蒸馏水或氢氧化钠溶液或其它合理答案 HNO3 Cr2O72-+2NO+6H+= 2Cr3++2NO3-+3H2O 取少量装置D中反应后的固体于洁净的试管中,滴加适量稀硫酸,试管口有红棕色气体产生 排放NO气体,污染环境 产品中混有Ca(NO3)2杂质
【解析】
(1)、装置中含有空气,空气中氧气能氧化一氧化氮,所以通入氮气的目的是排除装置中氧气,防止其将生成的一氧化氮氧化生成二氧化氮;
(2)、硝酸易挥发;
(3)、反应中Cr2O72-被还原成Cr3+,NO氧化为NO3-,根据电子得失守恒与质量守恒配平;
(4)、根据Ca(NO3)2与酸会发生反应产生NO气体,NO气体遇氧气生成红棕色NO2气体;
(5)、①若n(NO):n(NO2)>1:1,则一氧化氮过量;②若<1: 1,则二氧化氮过量。
(1)、装置中含有空气,空气中氧气能氧化一氧化氮,所以通入氮气的目的是排除装置中氧气,防止其将生成的一氧化氮氧化生成二氧化氮;
故答案为:2NO+O2=2NO2;
(2)、硝酸易挥发,通过B中盛放的蒸馏水或氢氧化钠溶液洗去硝酸,以防止过氧化钙反应生成氧气。
故答案为:蒸馏水或氢氧化钠溶液或其它合理答案;HNO3;
(3)、反应中K2Cr2O7被还原成Cr3+,NO氧化为NO3-,离子反应方程式为:Cr2O72-+2NO+6H+= 2Cr3++2NO3-+3H2O;
故答案为:Cr2O72-+2NO+6H+= 2Cr3++2NO3-+3H2O;
(4)、Ca(NO3)2溶液遇酸会产生NO气体,NO气体遇氧气生成红棕色NO2气体,所以取少量E中反应后的固体于试管中,滴加少许硫酸,试管口有红棕色气体生成即可证明E中有亚硝酸钙生成;
故答案为:取少量装置E中反应后的固体于洁净的试管中,滴加适量稀硫酸,试管口有红棕色气体产生,则装置E中有亚硝酸钙生成;
(5)①、若n(NO):n(NO2)>l:l,则一氧化氮过量,排放气体中NO含量升高,污染环境。
②、若n(NO):n(NO2)<l:l,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2;
故答案为:排放NO气体,污染环境;产品中混有Ca(NO3)2杂质。

