 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O⇌HCl+HC10K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
(1)氯碱工业生产氯气的化学方程式为
| ||
| ||
(2)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
(3)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂.我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图).
①下列溶液能吸收Cl2的是
A.饱和食盐水 B.饱和Na2SO3溶液
C.饱和NaOH溶液 D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是
③Cl2中含有少量HCl气体,可用
参考答案:
(2)氯气与烧碱溶液反应生成NaCl和NaClO;
(3)反应反应物和生成物结合质量守恒定律可书写化学方程式;
(4)①根据氯气具有氧化性以及能与碱反应的性质判断;
②可用淀粉碘化钾试纸检验;
③氯水中存在Cl2+H2O⇌HCl+HClO平衡,为可逆反应,根据浓度对平衡一定的影响分析.
| ||
故答案为:2NaCl+2H2O
| ||
(2)氯气与烧碱溶液反应生成NaCl和NaClO,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(3)反应物为Cl2和NaClO2,根据题意结合质量守恒定律可知生成物应为ClO2和NaCl,
则反应的方程式为Cl2+2NaClO2═2ClO2+2NaCl,
故答案为:Cl2+2NaClO2═2ClO2+2NaCl;
(4)①A.氯气难溶于饱和食盐水,故A错误;
B.氯气具有氧化性,可与饱和Na2SO3溶液发生氧化还原反应而被吸收,故B正确;
C.氯气和与饱和NaOH溶液反应而被吸收,故C正确;
D.浓硫酸与氯气不反应,不能吸收氯气,故D错误.
故答案为:BC;
②氯气可氧化KI生成单质碘,淀粉遇碘变蓝色,则可用湿润淀粉碘化钾试纸检验,现象为试纸变蓝,
故答案为:湿润淀粉碘化钾试纸变蓝;
③氯水中存在Cl2+H2O⇌HCl+HClO平衡,为可逆反应,饱和食盐水中Cl-抑制氯气与水的反应,平衡会逆向移动,有效降低Cl2在饱和食盐水中的溶解度,
故答案为:饱和食盐水;增大Cl-浓度,Cl2+H2O⇌HCl+HClO平衡会逆向移动,有效降低Cl2在饱和食盐水中的溶解度.
-
科目: 来源: 题型:
查看答案和解析>>(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
A. 饱和食盐水 B. 饱和Na2SO3溶液
C. 饱和NaOH溶液 D. 浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是
。
-
科目: 来源:2012届北京市海淀区高三上学期期中练习化学试卷 题型:填空题
查看答案和解析>>(11分)氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)使用氯气为自来水消毒可以有效 地控制次氯酸的浓度,请结合平衡常数解释原因: 。
地控制次氯酸的浓度,请结合平衡常数解释原因: 。
(3)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
②能说明Cl2的氧化性强于I2的实验现象是A.饱和食盐水 B.饱和Na2SO3溶液 C.饱和NaOH溶液 D.浓硫酸
。
③请用原子结构知识解释Cl2的氧化性强于I2的原因: -
科目: 来源:2012届福建省大田第一中学高三第一学期联合命题考试化学试卷 题型:填空题
查看答案和解析>>(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。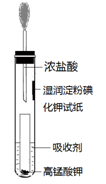
①下列溶液能吸收Cl2的是 (填字母序号)。
②能说明Cl2的氧化性强于I2的实验现象是A.饱和食盐水 B.饱和Na2SO3溶液 C.饱和NaOH溶液 D.浓硫酸
。 -
科目: 来源:2011-2012学年福建省高三第一学期联合命题考试化学试卷 题型:填空题
查看答案和解析>>(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O
 HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
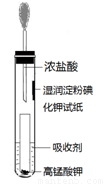
①下列溶液能吸收Cl2的是 (填字母序号)。
A. 饱和食盐水 B. 饱和Na2SO3溶液
C. 饱和NaOH溶液 D. 浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是
。
相关试题

