
【题目】苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化生成芳香酸,反应如下:
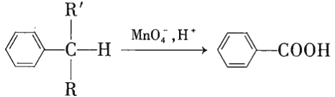 (
(![]() 、
、![]() 表示烃基氢原子)
表示烃基氢原子)
(1)现有苯的同系物甲、乙,分子式都是![]() 。甲不能被酸性高锰酸钾溶液氧化生成芳香酸,则甲的结构简式是_________;乙能被酸性高锰酸钾溶液氧化生成分子式为
。甲不能被酸性高锰酸钾溶液氧化生成芳香酸,则甲的结构简式是_________;乙能被酸性高锰酸钾溶液氧化生成分子式为![]() 的芳香酸,则乙可能的结构有___________种。
的芳香酸,则乙可能的结构有___________种。
(2)有机物丙也是苯的同系物,分子式也是![]() ,它的苯环上的一溴代物只有一种。试写出丙所有可能的结构简式:________。
,它的苯环上的一溴代物只有一种。试写出丙所有可能的结构简式:________。
【答案】 9
9  、
、![]() 、
、 、
、
【解析】
根据给出的信息可知,和苯环直接相连的碳原子上有氢原子,则此烃基可以被酸性高锰酸钾溶液氧化为一个羧基。
(1)苯的同系物甲,分子式为![]() ,不能被酸性高锰酸钾溶液氧化生成芳香酸,则甲分子中和苯环直接相连的碳原子上没有氢原子,则甲的结构简式是
,不能被酸性高锰酸钾溶液氧化生成芳香酸,则甲分子中和苯环直接相连的碳原子上没有氢原子,则甲的结构简式是 ;苯的同系物乙,分子式也为
;苯的同系物乙,分子式也为![]() ,乙能被酸性高锰酸钾溶液氧化生成分子式为
,乙能被酸性高锰酸钾溶液氧化生成分子式为![]() 的芳香酸,说明乙的苯环上有两个取代基,而且和苯环直接相连的碳原子上有氢原子,则乙分子中苯环上的两个取代基可能是两个乙基,或一个甲基和一个丙基,或一个甲基和一个异丙基,都有邻、间、对三种不同位置,所以乙的可能的结构有9种。
的芳香酸,说明乙的苯环上有两个取代基,而且和苯环直接相连的碳原子上有氢原子,则乙分子中苯环上的两个取代基可能是两个乙基,或一个甲基和一个丙基,或一个甲基和一个异丙基,都有邻、间、对三种不同位置,所以乙的可能的结构有9种。
(2)有机物丙也是苯的同系物,分子式也是![]() ,它的苯环上的一溴代物只有一种。若苯环上有两个取代基,只可能在对位上各有一个乙基,即
,它的苯环上的一溴代物只有一种。若苯环上有两个取代基,只可能在对位上各有一个乙基,即 ;若有三个取代基,苯环上的一溴代物不可能只有一种;若有四个取代基,即四个甲基,连在苯环上的位置有三种,即
;若有三个取代基,苯环上的一溴代物不可能只有一种;若有四个取代基,即四个甲基,连在苯环上的位置有三种,即![]() 、
、 、
、 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
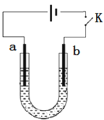
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法正确的是( )
A.a为石墨,b为铁钉
B.阴极主要发生反应 4OH--4e-== O2↑+ 2H2O
C.高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A.lmol晶体硅含Si-Si键的数目为2NA,则1mol金刚砂含C-Si键的数目也为2NA
B.Ca(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式:![]()
则Mg(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式: ![]()
C.标准状况下,22.4 L CO2中所含的分子数目为NA个,则22.4 LCS2中所含的分子数目也为NA个
D.NaClO溶液中通人过量CO2发生了反应:![]() ,则Ca(ClO)2溶液中通入过量CO2发生了:
,则Ca(ClO)2溶液中通入过量CO2发生了:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。

已知:①E能够发生银镜反应,1 mol E能够与2 mol H2完全反应生成F;
②R—CH=CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B:________________。
(2)E的结构简式为_______________________。
(3)C与新制Cu(OH)2反应的化学方程式为________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为__________。
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式为____________________。
(6)以丙烯等为原料合成D的路线如下:

X的结构简式为________,步骤Ⅱ的反应条件为_________,步骤Ⅳ的反应类型为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯分子中不存在碳碳单键和碳碳双键的交替结构,下列可以证明该结论的事实是( )
①苯不能使酸性![]() 溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
A.②③④B.②④⑥C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.平衡后升高温度,容器中气体颜色加深
B.每消耗44.8 LNO2,生成N2O4的分子数一定为NA
C.该容器中气体质量为46 g时,原子总数为3NA
D.若N2O4分子数增加0.5NA,则放出0.5a kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用乙醇制备溴乙烷:CH3CH2OH+HBr![]() CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
A.制备过程中可能看到有气泡产生
B.可以将适量的NaBr、H2SO4(浓![]() 、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
C.如在夏天做制备CH3CH2Br的实验,实际收集到的产物可能较少
D.为了除去CH3CH2Br中混有的HBr,可用热的NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯(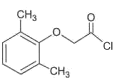 )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为__________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________ (用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com