【题目】安全存储与运输有机化合物,避免造成污染是重要的社会责任。C-9芳烃主要指催化重整和裂解制乙烯副产物中的含九个碳原子的芳香烃,沸点在153℃左右。下列说法不正确的是
A. 得到C-9芳烃的过程中发生了化学变化
B. ![]() 是C-9芳烃的组分之一
是C-9芳烃的组分之一
C. C-9芳烃常温下为液态,密度比水小
D. 运输C-9芳烃的车辆所贴的危险化学品标志是
参考答案:
【答案】B
【解析】
A. C-9芳烃主要指催化重整和裂解制乙烯的副产物之一,则得到C-9芳烃的过程中发生了化学变化,故A项正确;
B. C-9芳烃是含九个碳原子的芳香烃,![]() 分子中含7个碳原子,不属于C-9芳烃,故B项错误;
分子中含7个碳原子,不属于C-9芳烃,故B项错误;
C. C-9芳烃沸点在153℃左右,则常温下为液态,液态烃类有机物密度一般比水小,则C-9芳烃密度比水小,故C项正确;
D. 大多数含碳有机物都易燃,C-9芳烃是易燃液体,故D项正确;
答案选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
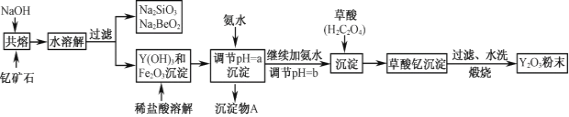
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子
开始沉淀时的pH
完全沉淀时的pH
Fe3+
2.1
3.1
Y3+
6.0
8.2
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为__________。
(3)根据元素周期表的知识判断,常温下,氯化锶溶液pH____7(填“大于”、“等于”或“小于”);写出氯化锶的电子式:______________________。
(4)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(5)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________;检验Fe3+是否沉淀完全的操作方法是:___________________________________。
(6)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列离子方程式书写正确的是( )
A.向NH4HSO4溶液中加入少量NaOH稀溶液:NH4++OH-=NH3·H2O
B.Cl2通入氢碘酸溶液中:Cl2+2HI=I2+2H++2Cl-
C.向Ca(ClO)2溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3-
D.NO2通入AgNO3溶液中:3NO2+H2O=2NO3-+NO+2H+
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、
 等)中回收碘,实验过程如下:
等)中回收碘,实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_______;该操作将I2还原为I-的目的是___________________。
(2)操作
 的名称为__________。
的名称为__________。(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是__________________;仪器a的名称为________;仪器b中盛放的溶液为__________。

(4)已知:
 ;某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
;某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。①取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②_______________________________________________________________________________;
③另从水层中取少量溶液,加入1-2mL淀粉溶液,加盐酸酸化后,滴加Na2SO3溶液,若溶液变蓝说明废水中含有IO3-;否则说明废水中不含有IO3-。
(5)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用ClO2氧化酸性含废液回收碘。完成ClO2氧化I-的离子方程式:________________________________。
(6)“碘量法”是一种测定S2-含量的有效方法。立德粉ZnS·BaSO4是一种常用的白色颜料,制备过程中会加入可溶性的BaS,现用“碘量法”来测定立德粉样品中S2-的含量。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol/L 的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000 mol/L Na2S2O3 滴定,反应式为I2 + 2S2O32-=2I-+ S4O62-。测定消耗Na2S2O3溶液体积V mL。立德粉样品S2-含量为__________(写出表达式)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应不属于取代反应的是
A. CH2=CH2 + H2O
 CH3CH2OH
CH3CH2OHB.
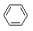 +Br2
+Br2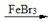
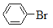 +HBr
+HBrC. 2CH3CH2OH
 C2H5—O—C2H5 + H2O
C2H5—O—C2H5 + H2OD.
 +HNO3
+HNO3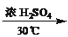
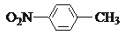 +H2O
+H2O -
科目: 来源: 题型:
查看答案和解析>>【题目】如图是硫酸试剂标签上的部分内容,据此下列说法正确的是( )

A.该硫酸试剂的物质的量浓度为18.4mol·L-1
B.该硫酸可以干燥H2S等酸性气体,但不可以干燥NH3
C.50mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46mol
D.2.7gAl与足量的该硫酸反应可得到H23.36L
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用如图中的装置可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是( )

A.装置C中氧化剂和还原剂的物质的量之比为2:3
B.装置B中加入的物质可以是碱石灰或无水氯化钙
C.装置D中液体可以使干燥的红色石蕊试纸变蓝
D.装置A中加入的固体,可以是NH4HCO3或NH4Cl
相关试题

