【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。

参考答案:
【答案】 1s22s22p63s23p63d74s2或[Ar]3d74s2 3 高于 H2O分子间可形成氢键 sp3 极性 6 八面体 5 金属 > 12 ![]()
【解析】(1)钴元素基态原子的电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2;未成对电子数为3个;
(2) ①H2O的沸点高于H2S,原因是H2O分子间可形成氢键;H2O中O的杂化形式为sp3;水分子是极性分子;②在配合物[Co(NH3)4(H2O)2]Cl3中,Co3+配位数为6;其阳离子的立体构型是八面体;若[Co(NH3)4(H2O) 2]Cl3中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O) 2] 3+的几何异构体种数有五种,
(3) 金属钴是由金属键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,由于Co2+的离子半径74.5pm小于Fe2+的离子半径78pm,所以CoO的熔点高于FeO的;
(5)由CoO的晶胞结构可知,每个Co2+的周围与它最接近的且距离相等的Co2+共有12个;若晶体中Co2+与O2-的最小距离为acm,即该晶胞的边长为2a cm,其体积为8 a3 cm3,该晶胞含有4个CoO分子,其质量为![]() g,则其密度为
g,则其密度为![]() g/cm3;
g/cm3;
-
科目: 来源: 题型:
查看答案和解析>>【题目】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g)
 C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1②C3H8(g)
 C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol③C2H4(g)+H2(g)
 C2H6(g) △H3
C2H6(g) △H3④C3H8(g) +H2(g)
 CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol(1)计算反应③的反应热△H3=______________。
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图像判断△H2____0,工业生产中采用的温度600-650℃,原因是__________________。
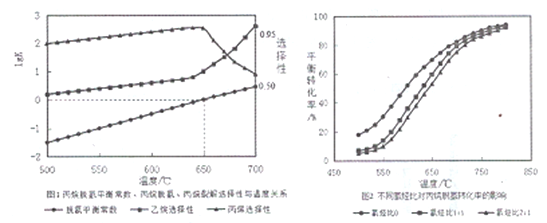
(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________(已知:
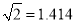 )
)(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质不能通过化合反应制得的是( )
A. Fe(OH)3 B. Fe(OH)2 C. CaSiO3 D. FeCl3
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3:
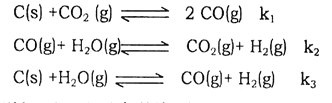
则K1、K2、K3之间的关系是K3=__________________
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计)________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫代硫酸钠(Na2S2O3)是常用的定影剂、还原性分析试剂。Na2S2O3·5H2O是无色晶体,易溶于水,不溶于乙醇,在潮湿的空气中易潮解,Na2S2O3和甲醛能形成难被碘溶液氧化的化合物。甲、乙两个兴趣小组用下列装置在实验室制备硫代硫酸钠。
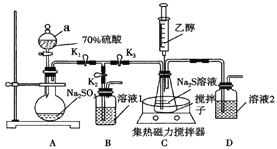
回答下列问题:
(1)仪器a的名称是____________;溶液1是____________。
(2)甲小组按上图连接好装置,打开K1、K3,关闭K2,打开仪器a的活塞;片刻后,打开集热式磁力搅拌器加热;将气体通入锥形瓶中,溶液出现黄色浑浊后逐渐消失,相关的化学反应方程式为:①_________________;②Na2SO3+S
 Na2S2O3。
Na2S2O3。(3)加热浓缩至出现少量晶膜,停止加热,打开K2,关闭K3,用注射器注入无水乙醇后有大量晶体析出。加入乙醇的作用是__________________________________。
(4)乙小组在制备Na2S2O3时进行了改进。将C装置中的溶液换为Na2CO3和Na2S混合液,其反应为:Na2CO3+Na2S+4SO2=3Na2S2O3+CO2。配制该混合溶液的过程中,先将Na2CO3完全溶解,再将Na2S溶解于Na2CO3的溶液中,其目的是__________________。
(5)测定乙小组产品纯度。取3.000gNa2S2O3·5H2O晶体,配成100mL溶液,取20.00mL于锥形瓶,调节溶液的pH至6,加入适量甲醛溶液和Zn(CH3COO)2溶液,过滤,洗涤,在滤液中滴加几滴淀粉溶液,用0.1000mol/L标准碘溶液滴定,消耗标准碘溶液10.00mL。
①加入适量甲醛溶液和Zn(CH3COO)2溶液的目的是_________________________________。
②该产品中Na2S2O3·5H2O的质量分数为_____________。 (已知:2Na2S2O3+I2=Na2S4O6+2NaIKsp(ZnS)=1.6×10-24 M(Na2S2O3·5H2O)=248g/mol)
-
科目: 来源: 题型:
查看答案和解析>>【题目】在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A,B两容器中气体的体积之比是( )
A.1:2
B.2:1
C.1:1
D.无法比较 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于有机化合物的说法正确的是
A. 制备聚四氟乙烯的单体属于不饱和烃
B. 分子式为C4H10O的醇有4种同分异构体
C. 苯乙烯(
 )分子的所有原子不可能在同一平面上
)分子的所有原子不可能在同一平面上D. 异丁烯及甲苯均能使溴水褪色,且褪色原理相同
相关试题

