【题目】碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是 。
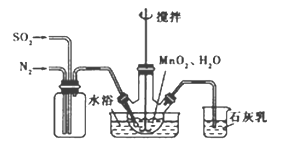
(2)实验室模拟工业二氧化锰制备硫酸锰装置如图
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
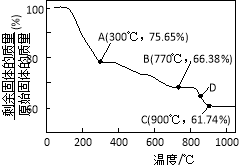
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
参考答案:
【答案】(1)加入稍过量的NH4HCO3能提高MnSO4的转化率,使MnCO3沉淀完全
(2)①Ca(OH)2十SO2=CaSO3+H2O;
②控制适当的温度、缓慢通人混合气体
⑶1∶2 (3分) Mn3O4和MnO(或其他合理表达)
【解析】
试题分析:(1)MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4;加入稍过量的NH4HCO3的目的是提高MnSO4的转化率,使MnCO3沉淀完全;
(2)根据制备硫酸锰装置图,
①石灰乳是防止二氧化硫污染空气,参与反应的化学方程式为Ca(OH)2十SO2=CaSO3+H2O。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有控制适当的温度、缓慢通人混合气体。
(3)⑶设MnCO3的物质的量为1 mol,即质量为115 g
①A点剩余固体质量为115 g×75.65%=87 g
减少的质量为115 g-87 g=28 g
可知MnCO3失去的组成为CO
故剩余固体的成分为MnO2
②C点剩余固体质量为115 g×61.74%=71 g
据锰元素守恒知m(Mn)=55 g,则m(O )1=71 g-55 g=16 g
则n(Mn)∶n(O)=![]() ∶
∶![]() =1∶1
=1∶1
故剩余固体的成分为MnO
同理,B点剩余固体质量为115 g×66.38%=76.337 g
因m(Mn)=55 g,则m(O )2=76.337 g-55 g=21.337 g
则n(Mn)∶n(O)=![]() ∶
∶![]() =3∶4
=3∶4
故剩余固体的成分为Mn3O4
因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关活化分子的说法正确的是( )
A.增大反应物浓度可以提高活化分子百分数
B.增大体系的压强一定能提高活化分子百分数
C.使用合适的催化剂可以增大活化分子的能量
D.升高温度能提高活化分子百分数 -
科目: 来源: 题型:
查看答案和解析>>【题目】密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为

A. 2:7 B. 5:4 C. 1:1 D. 7:2
-
科目: 来源: 题型:
查看答案和解析>>【题目】【化学——选修3物质结构与性质】已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由小到大的顺序为________(填元素符号)。
(3)E(BD)4为无色或黄色挥发性剧毒液体,熔点-19.3℃,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,E与BD之间的作用力为 。
(4)①写出一种与BD32-互为等电子体的分子的化学式 。
②含F2+的溶液与K2SO4、氨水反应可得到化合物 [F(NH3)4]SO4。1 mol配合物离子[F(NH3)4]2+中含σ键的数目为 。

③ E元素与镧(La)元素的合金可做储氢材料,该晶体的晶胞如图所示,晶胞中心有一个E原子,其他E原子都在晶胞面上,则该晶体的化学式为 ;已知该合金的摩尔质量为M gmol-1,晶胞参数为a pm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是

A.该硫酸的物质的量浓度为18.4 mol/L
B.该硫酸常用做干燥剂
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L
-
科目: 来源: 题型:
查看答案和解析>>【题目】对于反应A(g)+3B(g)=4C(g)+2D(g),在相同时间内,用不同物质表示的平均反应速率如下,则反应速率最快的是( )
A.v(A)=0.4 mol/(L·s)
B.v(B)=0.8 mol/(L·s)
C.v(C)=1.2 mol/(L·s)
D.v(D)=0.7 mol/(L·s) -
科目: 来源: 题型:
查看答案和解析>>【题目】在蒸发皿中加热蒸干下列物质的溶液,再灼烧(溶液低于400℃)可以得到原溶质固体的是( )
A.AlCl3
B.NaHCO3
C.MgSO4
D.KMnO4
相关试题

