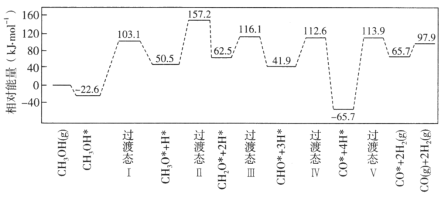
【题目】在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。
(1)![]() 的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
(2)在一定温度下,CO和H2混合气体发生反应:![]() ,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,
,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,![]() 将___________(填“增大”、“减小”或“不变”);若升高温度,
将___________(填“增大”、“减小”或“不变”);若升高温度,![]() 将____________(填“增大”、“减小”或“不变”)。
将____________(填“增大”、“减小”或“不变”)。
(3)353K时,在刚性容器中充入CH3OH(g),发生反应:![]() 。体系的总压强p随时间t的变化如表所示:
。体系的总压强p随时间t的变化如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
p/kPa | 101.2 | 107.4 | 112.6 | 116.4 | 118.6 | 121.2 |
①若升高反应温度至373K,则CH3OH(g)分解后体系压强p∞(373K)___________121.2kPa(填“大于”、“等于”或“小于”),原因是________________________。
②353K时,该反应的平衡常数KP=__________(kPa)2(KP为以分压表示的平衡常数,计算结果保留1位小数)。
【答案】+97.9 179.6 CO*+4H*=CO*+2H2(g)或4H*=2H2(g) 不变 减小 大于 CH3OH(g)CO(g)+2H2(g)的正反应为气体体积增大的吸热反应,温度升高,平衡右移,气体物质的量增加,容器体积不变,总压强变大 43.9
【解析】
(1)根据△H=生成物总能量-反应物总能量分析判断,根据图像,反应历程中活化能最大的为CO+4H阶段;
(2)平衡时正逆反应速率相等,催化剂可加快反应速率,但不影响平衡移动;根据(1)中分析CH3OH(g)CO(g)+2H2(g)的正反应为吸热反应,则CO(g)+2H2(g) CH3OH(g)的正反应为放热反应,升高温度平衡逆向移动;
(3)①反应CH3OH(g)CO(g)+2H2(g)的正反应为气体体积增大的吸热反应,根据外界条件对该平衡体系的影响分析判断;
②根据相同条件下,物质的量之比等于压强之比,结合三段式计算解答。
(1)根据图像显示,甲醇的相对能量为0,生成物相对能量为97.9 kJ·mol-1,根据△H=生成物总能量-反应物总能量,则![]() 的△H=+97.9kJ·mol-1;根据图像可以看出,CO+4H= CO+2H2(g)(或4H*=2H2(g))反应历程中活化能E正最大为113.9kJ/mol-(-65.7kJ/mol)=179.6 kJ·mol-1;
的△H=+97.9kJ·mol-1;根据图像可以看出,CO+4H= CO+2H2(g)(或4H*=2H2(g))反应历程中活化能E正最大为113.9kJ/mol-(-65.7kJ/mol)=179.6 kJ·mol-1;
(2)平衡时正逆反应速率相等,即υ正= υ逆,则![]() =1,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH)=0,则该反应的平衡常数K=
=1,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH)=0,则该反应的平衡常数K=![]() =
=![]() ,催化剂可加快反应速率,但不影响平衡移动,正逆反应速率仍相等则
,催化剂可加快反应速率,但不影响平衡移动,正逆反应速率仍相等则![]() 不变;根据(1)中分析CH3OH(g)CO(g)+2H2(g)的正反应为吸热反应,则CO(g)+2H2(g) CH3OH(g)的正反应为放热反应,升高温度反应逆向移动,平衡常数K减小,则
不变;根据(1)中分析CH3OH(g)CO(g)+2H2(g)的正反应为吸热反应,则CO(g)+2H2(g) CH3OH(g)的正反应为放热反应,升高温度反应逆向移动,平衡常数K减小,则![]() 将减小;
将减小;
(3)①反应CH3OH(g)CO(g)+2H2(g)的正反应为气体体积增大的吸热反应,温度升高,平衡右移,气体物质的量增加,容器体积不变,总压强变大,则升高反应温度至373K,则CH3OH(g)分解后体系压强p∞(373K)大于121.2kPa;
②353K时,初始时平衡体系总压强为101.2 kPa,平衡时体系总压强为121.2kPa,设初始投入CH3OH(g)为1mol,平衡时消耗CH3OH(g)的物质的量为x,列“三段式”:
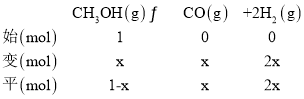
根据相同条件下,物质的量之比等于压强之比,则![]() ,解得x=
,解得x=![]() mol,则平衡时,H2的物质的量为
mol,则平衡时,H2的物质的量为![]() mol,CH3OH的物质的量为(
mol,CH3OH的物质的量为(![]() )mol,CO的物质的量为
)mol,CO的物质的量为![]() mol,平衡时的总物质的量为
mol,平衡时的总物质的量为![]() mol,该反应的平衡常数KP
mol,该反应的平衡常数KP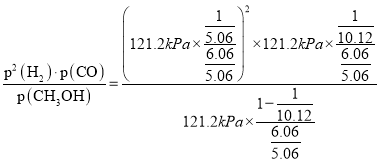 =43.9(kPa)2。
=43.9(kPa)2。

