

【题目】常温下,用 0.1000mol/L NaOH溶液滴定 20.00mL0.1000mol/L某一元酸HA溶液,滴定曲线如图。下列说法正确的是
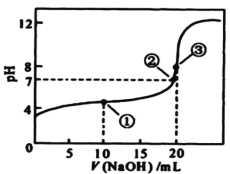
A.该滴定过程既能用甲基橙又能用酚酞作指示剂
B.点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C.点②所示溶液中:c(Na+) =c(HA) +c(A-)
D.水的电离程度随着NaOH溶液的滴入不断增大
【答案】B
【解析】
A.结合“用 0.1000mol/L NaOH溶液滴定 20.00mL0.1000mol/L某一元酸HA溶液”,恰好完全反应时消耗NaOH溶液20mL,由图知反应后溶液pH大于7,常温下,溶液显碱性,推知用酚酞作指示剂,A项错误;
B.由题可知点①溶质为等量的HA和NaA,由图知溶液显酸性(c(H+) >c(OH-)),则HA的电离程度大于A-的水解程度,则c(A-) >c(Na+)>c(H+) >c(OH-),B项正确;
C.由电荷守恒知c(Na+)+c(H+) =c(OH-)+ c(A-),又点②pH=7,则c(H+) =c(OH-),推知c(Na+) = c(A-),则c(Na+) <c(HA) +c(A-),C项错误;
D.加入NaOH溶液生成NaA,则A-的水解促进水的电离,当酸碱恰好完全反应后,继续滴加NaOH溶液,则OH-会抑制水的电离,D项错误;
故选B。


科目:高中化学 来源: 题型:
【题目】在催化剂的作用下会发生反应:CO(g)+2H2(g)CH3OH(g)。回答下列问题:
(1)某温度下,将2molCO与5molH2的混合气体充入容积为2L 的恒容密闭容器中,经过5 min 后,反应达到平衡,此时转移 6 mol电子。从起始至平衡时v(CH3OH)=______mol·L-1·min-1,该反应的平衡常数为______L2·mol-2。
(2)在一定压强下,向容积为V L的容器中充入a molCO与2a molH2,在催化剂作用下反应生成甲醇,CO 平衡转化率与温度、压强的关系如图所示。
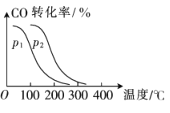
①p1____(填“>” “<”或“=”,下同)p2,△H_____0。
②下列能使该反应的化学反应速率增大,且平衡向正反应方向移动的是 __________(填字母)。
A.及时分离出CH3OH气体 B.适当升高温度
C.增大H2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )

A.气态氢化物的稳定性:R>W
B.X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C.Y和Z两者最高价氧化物对应的水化物能相互反应
D.由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
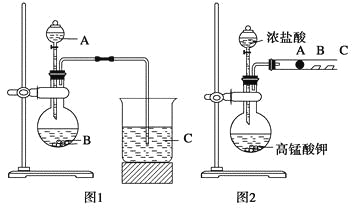
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
上述反应的离子方程式分别为______________________________________________;
________________________________________________________________________。
(2)乙同学的实验原理是________________________________________________。
写出B处的离子方程式: _________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
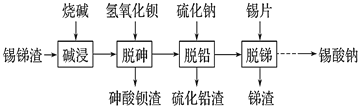
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。
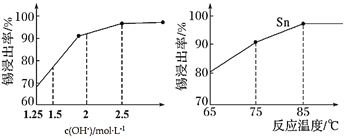
(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是( )
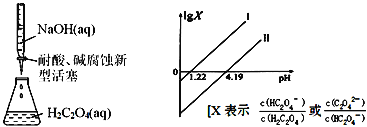
A.Ka2(H2C2O4)=10-4.19
B.直线Ⅰ中X=![]()
C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.Ⅰ、Ⅱ两条直线的斜率均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3 ,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7 ·2H2O),其主要工艺流程如下图:

查阅资料得知:
i.常温下,NaBiO3 不溶于水,有强氧化性,在碱性条件下,能将 Cr 3+ 转化为CrO42- 。
ii.

回答下列问题:
(1)步骤③加的试剂为氢氧化钠溶液,此时溶液 pH 要调到5的目的是_________ 。
(2)写出④反应的离子反应方程式:________________
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是____________ (填操作名称)。
(4)取一定质量的固体 D 溶解于 200mL 的硫酸中,向所得溶液中加入5mol/L 的NaOH 溶液,生成沉淀的物质的量n与加入NaOH 溶液的体积V 关系如图所示,则硫酸的浓度为_______ ,固体 D 中含铁化合物的物质的量为__________ 。

Ⅱ.经检测该化工厂的工业废水中含 5.00×10 -3 mol·L -1 的 Cr2O72- ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4 (Fe 的化合价依次为+3、+2),又设计了如下工艺流程:

(1)第①步反应的离子方程式_______________ 。
(2)欲使 1L 该废水中的 Cr2O72- 完全转化为 Cr 0.5 Fe 1.5 FeO4 。理论上需要加FeSO4 ·7H2O 的质量为 ________g (已知 FeSO 4 ·7H2O 的摩尔质量为 278g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。完成下列填空:
(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___。
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式___。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是___。
向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。
(3)反应过程中,溶液的pH逐渐___(填“变大”、“变小”),生成的沉淀是___;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是___。
a.c(Na+)=c(S2O32-) +2c(HSO3-)+2c(H2SO3) + 2c(HS-)
b.c(Na+)+c(H+)=2c(S2O32-)+c(HSO3-) +c(HS-) +c(OH-)
c.c(Na+)=2c(HS-)
d.c(Na+)=2c(HS-)+2c(S2O32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的密闭容器中,充入浓度分别为0.20mol·L-1、0.10mol·L-1 SO2和O2,发生反应:2SO2(g)+O2(g)2SO3(g)。当反应达到平衡时,不可能存在的数据是
A.SO2为0.10 mol·L-1B.O2为0.05mol·L-1
C.SO2为0 mol·L-1D.SO3为0.15 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com