
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的![]() 的原子和价电子排布为4s24p5的原子
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在平衡:NH3·H2O![]() NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
①适当升高温度 ②加入NH4Cl固体 ③通入NH3 ④加入少量盐酸
A.②④B.②③C.①②D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是中学化学中一种重要的物质。请回答下列问题:
Ⅰ.一定条件下,烧杯中H2O2溶液发生分解反应放出气体的体积和时间的关系如图所示:

则由D到A过程中,随着反应的进行反应速率逐渐_________(选填 “加快”或“减慢”),其变化的原因是________________________________________。
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。
(1)定性图甲可通过观察_________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______。

(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,实验中需要测量的数据是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块金属钠,用滤纸吸干表面的煤油,用小刀切开后,可看到断面呈____色,具有_____光泽,但断面很快变___________,主要是由于生成一薄层_______。若把钠放在石棉网上加热,可观察到的现象是_______________ ,反应的化学方程式为_______其中还原剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学小组拟用该装置制取纯净的O2。

(1)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是___。
(2)若C是一种黑色粉末,则B是_________,C的作用是________________。
(3)广口瓶中盛装的试剂D是___________,其作用是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下一系列转化关系,回答问题。已知:H是具有水果香味的液体,I的产量作为衡量一个国家的石油化学工业发展水平的标志,J为高分子化合物。

(1)A、B的名称分别是___、_____; D、F 的化学式为___________;I的结构简式______;
(2)写出化学方程式并指出反应类型:
C→E _____________,反应类型:____________。
G→H _______,反应类型:_______。
I→J _________________,反应类型:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。
I.(1)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+ 8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl21.5mol,则被氧化的NH3在标准状况下的体积为__________L,该过程中电子转移的总数为__________________ 个。
(2)黄绿色气体ClO2(其中氯元素价态为+4)可用于污水杀菌和饮用水净化。ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中还原剂与氧化剂的物质的量之比为________。
II.实验室可用如下装置制备氯气并验证氯气的性质置(其中夹持装置已省略)。
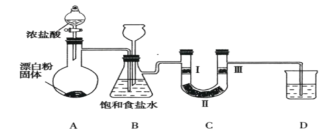
已知:装置A是氯气的发生装置,反应的化学方程式为Ca(ClO)2 + 4HCl(浓)═ CaCl2+2Cl2↑+2H2O据此回答下列问题:
(1)装置B中饱和食盐水的作用是_______。
(2)装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是:湿润的有色布条、无水氯化钙、干燥的有色布条,请你推测Ⅲ处的现象为:__________。
(3)装置D的作用是___________,则烧杯中的溶液是__________,写出所发生反应的化学方程式_____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分:
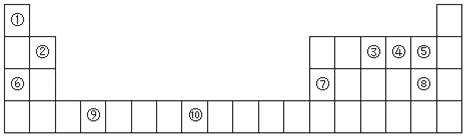
I.(1)元素③的基态原子轨道表示式为_________________。
(2)元素③④⑤的第一电离能由大到小的顺序为___________(填元素符号)。
(3)以下组合的原子间反应最容易形成离子键的是_____(选填A、B、C、D,下同)。
A.②和⑤ B.和⑤ C.⑤和⑥ D.⑥和⑧
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_________________________________。
II.(1)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。
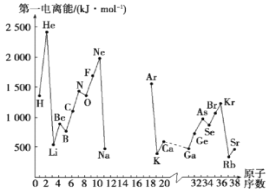
①根据同图示变化规律,可推测S的第一电离能的大小(最小)范围为___< S <___ (填元素符号)
②图中第一电离能最小的元素在周期表中的位置 ____________________
(2)用In表示元素的第n电离能,则图中的a、b、c分别代表(__________)
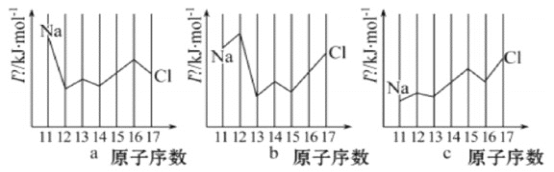
A.a为I1、b为I2、c为I3 B.a为I3、b为I2、c为I1
C.a为I2、b为I3、c为I1 D.a为I1、b为I3、c为I2
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的原电池可以测定AgCl的沉淀溶解平衡常数。有关该原电池的说法不正确的是
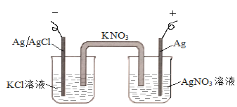
A.负极的电极反应式为:Ag+Cl--e-=AgCl
B.正极的电极反应式是Ag++ e-=Ag
C.电池总反应不是氧化还原反应,不能组成原电池
D.反应时,盐桥中的K+移向AgNO3溶液,NO3-移向KCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com