【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
【答案】B
【解析】
在5L密闭容器投入1molNH3和1molO2,2分钟后NO的物质的量增加了0.4mol,则:
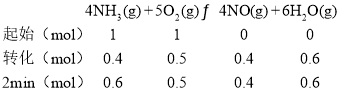
A.由热化学方程式可知生成4molNO,则放出akJ热量,则生成0.4molNO,则热量值为0.1akJ,故A错误;
B.用氧气表示2分钟的反应速率:v(O2)= =0.05molLmin-1,故B正确;
=0.05molLmin-1,故B正确;
C.2分钟内NH3的转化率是![]() ×100%=40%,故C错误;
×100%=40%,故C错误;
D.2分钟末c(H2O)=![]() =0.12mol/L,故D错误;
=0.12mol/L,故D错误;
故答案为B。

