【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为___。
(2)丙酮(CH3CCH3O)分子中碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___。
(3)C、H、O三种元素的电负性由小到大的顺序为____。
(4)乙醇的沸点高于丙酮,这是因为______。
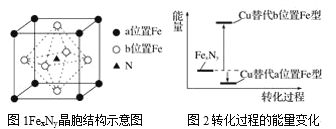
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为____。
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·cm-3。实验室制备少量1溴丙烷的主要步骤如下:步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20 mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
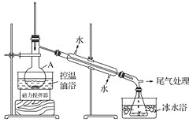
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1溴丙烷。
(1)仪器A的名称是___;加入搅拌磁子的目的是搅拌和___。
(2)反应时生成的主要有机副产物有2溴丙烷和____。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_____。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是___。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL5%Na2CO3溶液,振荡,___,静置,分液。
【答案】[Ar]3d5或1s22s22p63s23p63d5 sp2和sp3 9NA H<C<O 乙醇分子间存在氢键 Fe3CuN 蒸馏烧瓶 防止暴沸 丙烯、正丙醚 减少1溴丙烷的挥发 减少HBr挥发 将分液漏斗下口向上倾斜、打开活塞排出气体
【解析】
(1)铁的原子序数为26,位于第四周期Ⅷ族,![]() 核外电子数为23,其基态核外电子排布式为
核外电子数为23,其基态核外电子排布式为![]() 或
或![]() 。
。
(2)丙酮的甲基中碳原子的杂化方式为![]() 杂化,羰基中碳原子的杂化方式为
杂化,羰基中碳原子的杂化方式为![]() 杂化;1mol丙酮中含有6molC-H键,2molC-C键,1molC=O键,单键均为σ键,碳氧双键中含有1molσ键,所以1mol丙酮中含有9molσ键。
杂化;1mol丙酮中含有6molC-H键,2molC-C键,1molC=O键,单键均为σ键,碳氧双键中含有1molσ键,所以1mol丙酮中含有9molσ键。
(3)电负性是原子在分子中吸引成键电子的能力。同周期元素的电负性随原子序数的增大而增大,所以电负性![]() ,又因为在甲烷中碳元素显负化合价,吸引电子能力更强,所以电负性
,又因为在甲烷中碳元素显负化合价,吸引电子能力更强,所以电负性![]() ,故电负性
,故电负性![]() 。
。
(4)丙酮分子间只有范德华力,而乙醇存在分子间氢键,使其沸点升高。
(5)由晶胞示意图可知,一个![]() 晶胞中,含有铁原子的数目为
晶胞中,含有铁原子的数目为![]() ,氮原子的数目为1,所以x=4,y=1,由图-2可知,Cu替代该晶体中a位置Fe,可使能量降低,Cu替代该晶体中b位置Fe,可使能量升高,最稳定的Cu替代型产物为Cu完全替代该晶体中a位置Fe,即晶格中铜原子数目为
,氮原子的数目为1,所以x=4,y=1,由图-2可知,Cu替代该晶体中a位置Fe,可使能量降低,Cu替代该晶体中b位置Fe,可使能量升高,最稳定的Cu替代型产物为Cu完全替代该晶体中a位置Fe,即晶格中铜原子数目为![]() ,所以铁原子数目为3,所以最稳定的Cu替代型产物化学式为
,所以铁原子数目为3,所以最稳定的Cu替代型产物化学式为![]() 。
。
(1)仪器A是蒸馏烧瓶;搅拌磁子在磁力搅拌器的作用下旋转达到搅拌的目的,也能够在蒸馏过程中充当沸石的作用,防止液体暴沸。
(2)加热过程中,正丙醇会发生分子内脱水生成丙烯或分子间脱水生成正丙醚。
(3)步骤2中的馏出物温度较高,若不使用冰水浴降温,生成的1-溴丙烷会挥发,使得产率降低。
(4)步骤1混合物中的主要物质为正丙醇和HBr,若加热过急,会使得部分HBr挥发,缓慢加热,能够避免这一问题。
(5)分出的有机相中会含有未反应的氢离子,加入![]() 和水洗涤后,会生成
和水洗涤后,会生成![]() 气体,震荡后,要将分液漏斗下口向上倾斜,打开活塞排出气体,然后静置分液。
气体,震荡后,要将分液漏斗下口向上倾斜,打开活塞排出气体,然后静置分液。

