【题目】在下列溶液中,能大量共存的离子组是( )
A. 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B. 常温下pH=1的溶液中:Fe2+、Mg2+、NO3-、Cl-
C. 含有大量Fe3+的溶液中:SCN-、I-、K+、Br-
D. Ba2+、K+、SO42-、HCO3-、CO32-
参考答案:
【答案】A
【解析】A.使甲基橙变红色的溶液显酸性,Mg2+、K+、SO![]() 、NO 在酸性溶液中彼此间不发生离子反应,能大量共存,故A正确;B.N
、NO 在酸性溶液中彼此间不发生离子反应,能大量共存,故A正确;B.N![]() 在酸性溶液中能氧化Fe2+,而不能大量共存,故B错误;C.Fe3+与SCN-要生成配合离子,且能氧化I-,不能大量共存,故C错误;D.Ba2+与S
在酸性溶液中能氧化Fe2+,而不能大量共存,故B错误;C.Fe3+与SCN-要生成配合离子,且能氧化I-,不能大量共存,故C错误;D.Ba2+与S![]() 或C
或C![]() 均能生成能溶于水的盐,不能大量共存,故D错误;答案为A。
均能生成能溶于水的盐,不能大量共存,故D错误;答案为A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是____________(填序号)。
a.电解水制氢:2H2O
 2H2↑+O2↑
2H2↑+O2↑b.高温使水分解制氢:2H2O(g)
 2H2+O2
2H2+O2c.太阳光催化分解水制氢:2H2O
 2H2↑+O2↑
2H2↑+O2↑d.天然气制氢:CH4+H2O(g)
 CO+3H2
CO+3H2(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。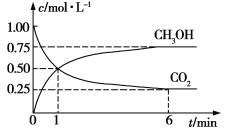
①从1 min到6 min,v(H2)=__________mol·L1·min1。
②能说明上述反应达到平衡状态的是_______(填编号)。
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3 mol H2,同时生成1 mol H2O
e.反应中CO2与H2的物质的量之比为1∶3且保持不变
-
科目: 来源: 题型:
查看答案和解析>>【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,22.4 L苯中含有的苯分子数为NA
B. 常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1mol/L的Ba(NO3)2溶液中含NO3- 离子数为2NA
D. 分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L ②若1 mol气体的体积为22.4 L,则它一定处于标准状况下 ③标准状况下,1 L HCl和1 L H2O的物质的量相同 ④标准状况下,1 g H2和14 g N2的体积相同 ⑤28 g CO的体积为22.4 L ⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同 ⑦在同温同体积时,气体物质的物质的量越大,则压强越大 ⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ⑤⑥⑦⑧ D. ④⑦⑧
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
(1)图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=
 。
。①图l中投料比相同,温度从高到低的顺序为________。
②图2中.m1、m2、m3投料比从大到小的顺序为________,理由是________。
(2)图3表示在总压为5MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。
①曲线b代表的物质为________(填化学式)。
②图3中P点时。CO2的转化率为________。
③T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
-
科目: 来源: 题型:
查看答案和解析>>【题目】向100mL碘化亚铁溶液中缓慢通入标况下4.48L氯气,完全反应后,溶液中有一半的Fe2+未被氧化,则原碘化亚铁溶液的物质的量浓度是( )
A. 1.2mol/L B. 1.5mol/L C. 1.6mol/L D. 2.0mol/L
相关试题

