
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式 ;
(2)浓硫酸的作用是: ;
(3)饱和碳酸钠溶液的主要作用是___ 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是________________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
【答案】(1)CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)催化剂;吸水剂;(3)除去乙酸,吸收乙醇,降低乙酸乙酯的溶解度;
(4)防止倒吸;(5)分液;(6)②④⑤。
【解析】
试题分析:(1)乙酸和乙醇发生酯化反应,酸去羟基,醇去氢,因此反应方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;(2)浓硫酸的作用是催化剂、吸水剂,吸收水,促使平衡向正反应方向进行;(3)出来的乙酸乙酯中混有乙酸、乙醇,因此碳酸钠的作用:吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度使之析出;(4)防止倒吸;(5)根据(3)的分析,此时试管中出现分层,上层为乙酸乙酯,因此采用分液的方法进行分离;(6)①用不同物质的速率表示达到平衡,要求反应方向一正一逆,且速率之比=化学计量数之比,生成1mol乙酸乙酯和1mol水,反应方向都是向正反应方向进行,故错误;②根据选项①的分析,故正确;③根据①分析,故错误;④根据化学平衡状态的定义,故正确;⑤根据化学平衡状态的定义,故正确。
CH3COOC2H5+H2O;(2)浓硫酸的作用是催化剂、吸水剂,吸收水,促使平衡向正反应方向进行;(3)出来的乙酸乙酯中混有乙酸、乙醇,因此碳酸钠的作用:吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度使之析出;(4)防止倒吸;(5)根据(3)的分析,此时试管中出现分层,上层为乙酸乙酯,因此采用分液的方法进行分离;(6)①用不同物质的速率表示达到平衡,要求反应方向一正一逆,且速率之比=化学计量数之比,生成1mol乙酸乙酯和1mol水,反应方向都是向正反应方向进行,故错误;②根据选项①的分析,故正确;③根据①分析,故错误;④根据化学平衡状态的定义,故正确;⑤根据化学平衡状态的定义,故正确。


科目:高中化学 来源: 题型:
【题目】浓度均为0.01 mol/L硫氰化钾与氯化铁溶液各100 mL在一定条件下反应:3KSCN +FeCl3![]() Fe(SCN)3 + 3KCl,达到平衡后向混合溶液加入5g下列固体(溶液体积变化忽略不计),不影响平衡的是
Fe(SCN)3 + 3KCl,达到平衡后向混合溶液加入5g下列固体(溶液体积变化忽略不计),不影响平衡的是
A.氯化铁 B.氯化钾 C.硫氰化钾 D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体
A.①②⑤ B.②③⑥ C.②③④⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的生产步骤有:①浓缩结晶脱水 ②加熟石灰 ③加盐酸 ④过滤 ⑤熔融电解,正确的生产顺序是
A.①②③④⑤ B.⑤④③①② C.②④③①⑤ D.③④②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
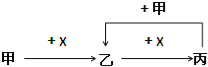
A. 甲为C,X为O2 B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2 D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知废水试样中可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO、Y、NO |
(1)离子X是________(填化学式,下同),离子Y是________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为______________________________________________
(3)丁组实验在酸性条件下发生反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
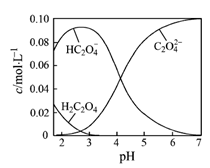
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断合理的是( )
A.Na2O2、Fe2O3和A12O3属于碱性氧化物
B.蔗糖、硫酸钠和硫酸钡分别属于非电解质、强电解质和弱电解质
C.根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
D.根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类的叙述正确的是( )
A.NaCl晶体不导电,所以NaCl是非电解质
B.Na2O2能与酸反应,所以Na2O2是碱性氧化物
C.BaSO4难溶于水,但BaSO4是强电解质
D.NH4Cl不含有金属离子,所以NH4Cl不是盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com