【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中
都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中![]() 与
与![]() 、
、![]() 与
与![]() 在周期表中相邻,
在周期表中相邻,![]() 原子核外有两个未成对电子,
原子核外有两个未成对电子,![]() 的第一电离能比同周期相邻两种元素的都大,
的第一电离能比同周期相邻两种元素的都大,![]() 原子在同周期元素原子中半径最大(稀有气体原子除外);
原子在同周期元素原子中半径最大(稀有气体原子除外);![]() 与
与![]() 位于不同周期,
位于不同周期,![]() 原子核外最外层电子数与
原子核外最外层电子数与![]() 相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
(1)![]() 、
、![]() 、
、![]() 、
、![]() 四种元素的电负性由大到小的排列顺序为_________。
四种元素的电负性由大到小的排列顺序为_________。
(2)![]() 的氢化物的结构式为_________,其分子的空间构型为________。
的氢化物的结构式为_________,其分子的空间构型为________。
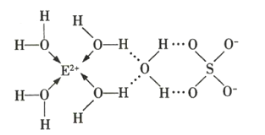
(3)![]() 的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。
的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。
(4)![]() 与
与![]() 的气态氢化物相比,_________(填化学式,下同)的沸点更高;
的气态氢化物相比,_________(填化学式,下同)的沸点更高;![]() 与
与![]() 的气态氢化物相比,________的沸点更高。
的气态氢化物相比,________的沸点更高。
(5)![]() 的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
【答案】![]()
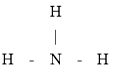 三角锥形 离子键、共价键、配位键、氢键
三角锥形 离子键、共价键、配位键、氢键 ![]()
![]() sp 直线形
sp 直线形
【解析】
由题意可知,A、B、D的相对位置为 ,且B的第一电离能比同周期相邻两种元素的都大,A原子核外有两个未成对电子,则B的
,且B的第一电离能比同周期相邻两种元素的都大,A原子核外有两个未成对电子,则B的![]() 轨道处于半充满状态,可推知B为N,A为C,D为
轨道处于半充满状态,可推知B为N,A为C,D为![]() 。由C原子在同周期元素原子中半径最大(稀有气体原子除外),可知C为
。由C原子在同周期元素原子中半径最大(稀有气体原子除外),可知C为![]() ,
,![]() 为第四周期的元素最外层有1个电子,其余各电子层均充满电子,则
为第四周期的元素最外层有1个电子,其余各电子层均充满电子,则![]() 的基态原子的电子排布式为
的基态原子的电子排布式为![]() ,
,![]() 为
为![]() 。
。
(1)A、B、C、D分别为![]() 、
、![]() ,根据电负性的递变规律可知,电负性:
,根据电负性的递变规律可知,电负性:![]() ,故答案为:
,故答案为:![]() ;
;
(2)B的氢化物为![]() ,中心原子
,中心原子![]() 采取
采取![]() 杂化,分子的空间构型为三角锥形,故答案为:
杂化,分子的空间构型为三角锥形,故答案为: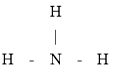 ;三角锥形;
;三角锥形;
(3)根据图示可判断出![]() 分子和
分子和![]() 间存在配位键,同时水分子间还存在氢键,
间存在配位键,同时水分子间还存在氢键,![]() 分子内存在共价键,该化合物中含有阴离子,还存在离子键,故答案为:离子键、共价键、配位键、氢键;
分子内存在共价键,该化合物中含有阴离子,还存在离子键,故答案为:离子键、共价键、配位键、氢键;
(4)A与B的气态氢化物分别为![]() 和
和![]() ,因
,因![]() 分子间存在氢键,故沸点:
分子间存在氢键,故沸点:![]() ;A与D的气态氢化物分别为
;A与D的气态氢化物分别为![]() 和
和![]() ,由于其结构相似,
,由于其结构相似,![]() 的相对分子质量大于
的相对分子质量大于![]() ,所以沸点:
,所以沸点:![]() ,故答案为:NH3;SiH4;
,故答案为:NH3;SiH4;
(5)![]() 中
中![]() 原子采取sp杂化,
原子采取sp杂化,![]() 分子呈直线形,故答案为:sp;直线形。
分子呈直线形,故答案为:sp;直线形。

