【题目】下列物质制备与工业生产相符的是( )
A. 浓盐酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
B. MgCl2溶液![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
C. FeS2![]() SO2
SO2![]() H2SO4
H2SO4
D. 饱和NaCl溶液![]() NaHCO3悬浊液
NaHCO3悬浊液![]() Na2CO3
Na2CO3
参考答案:
【答案】D
【解析】A.工业用电解饱和食盐水方法制取氯气,用浓盐酸与二氧化锰反应制氯气属于实验室制法,故A错误;B.工业上制Mg的工业流程:MgC12溶液:MgCl2(aq)直接蒸干会因为水解得到氧化镁,而得不到氯化镁,故B错误;C. FeS2在空气中加热氧化生成二氧化硫,二氧化硫在催化剂作用下继续被空气氧化生成三氧化硫,最后与水反应生成硫酸,故C错误;D.联合制碱法的工业流程:饱和NaCl溶液![]() NaHCO3晶体
NaHCO3晶体![]() Na2CO3,故D正确;故选D。
Na2CO3,故D正确;故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】若阿伏加德罗常数的数值用NA表示,下列说法正确的是(相对原子质量:H-1 D-2 He-4 N-14 O-16)
A. 标准状况下,1.12L 氦气所含原子数为0.1NA
B. 22.4 LHCl溶于水,溶液中H+数为NA
C. 1.6gNH2-离子所含电子数为NA
D. 10g D2O所含的中子数为4.5NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体。教师结合小明已有知识设计了下图所示装置进行实验。
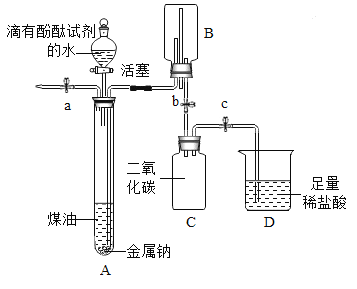
【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL。
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是__________。
(2)实验过程
操作
现象及解释
①
打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞。
液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中。由此可知金属钠的物理性质_______(写出一点即可)。
②
打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b。
反应的化学方程式为_____________.
③
打开止水夹c。
_______,溶液红色消失。
反应的化学方程式为_________。
④
将燃着的木条伸到导管尖嘴处,打开止水夹a;
在火焰上方罩一个干冷的烧杯。
气体燃烧,产生淡蓝色火焰
烧杯内壁有无色液滴生成,A中气体为氢气。
(3)反思分析
金属钠与水反应的化学方程式为_____________;
反应结束,C中溶液的溶质是_________(指示剂除外,写出所有可能)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在常温下,用0.100 0 mol·L-1的盐酸滴定25 mL 0.100 0 mol·L-1 Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
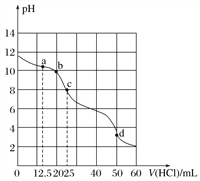
A. a点:c(HCO
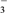 )>c(Cl-)>c(CO
)>c(Cl-)>c(CO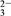 )
)B. b点:c(Na+)+c(H+)=c(Cl-)+c(HCO
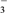 )+c(CO
)+c(CO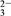 )+c(OH-)
)+c(OH-)C. c点:c(OH-)+c(CO
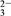 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)D. d点:c(Cl-)=c(Na+)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.HClO见光会分解,故氯水保存在棕色试剂瓶中
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价
-
科目: 来源: 题型:
查看答案和解析>>【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断不正确的是
A.沉淀H为Al(OH)3、BaCO3的混合物
B.根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C.溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+
D.若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol·L-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,有关下列溶液的说法不正确的是
A. 20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:
c(CH3COO-)c(Cl-)c(CH3COOH)c(H+)
B. 0.1mol/L Na2C2O4溶液与 0.1mol/L HCl 溶液等体积混合,所得溶液中:
2c(C2O42-)+c(HC2O4-)+ c(OH-)= c(Na+)+ c(H+)
C. 含等物质的量的NaHC2O4和Na2C2O4的溶液中:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D. 将amol/L氨水与0.01mol/L 盐酸等体积混合,若反应完全时溶液中 c(NH4+)=c(Cl-),则NH3·H2O的电离常数

相关试题

