【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量的铝铁合金与1000mL一定浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4.00mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
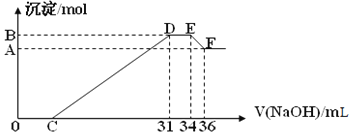
(1)原混合物中铝粉与铁粉的物质的量之比为______
(2)硝酸溶液的物质的量浓度为______molL-1
参考答案:
【答案】1:3 0.148
【解析】
(1)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化铝与氢氧化钠物质的量之比为1:1,EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al——Al(OH)3——NaOH→NaAlO2+2H2O
1 1
0.008mol 0.008mol
所以铝的物质的量为0.008mol;
D与E一段氢氧化钠被消耗,DE段是NH4NO3和NaOH反应
NH4NO3~NaOH
1 1
n(NH4NO3)=n(NaOH)=(34-31)×10-3L×4mol/L=0.012mol,
设铁有x mol,Al离子也是0.008mol,NH4+有0.012mol,根据电子守恒可得:3x+0.008×3=0.012×8,x=0.024mol,所以铁离子有0.024mol,根据原子守恒知,铁的物质的量是0.024mol,故原混合物中铝粉与铁粉的物质的量之比为0.008mol:0.024mol=1:3,故答案为:1:3;
(2)E点时,溶液中的溶质是硝酸钠和氨水,n(NH3H2O)=n(NH4+)=0.012mol,n(NaNO3)=n(NaOH)=34×10-3L×4mol/L=0.136mol,根据氮原子守恒知,c(HNO3)=0.148mol/L,故答案为:0.148。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________,据此推测,锡的常见正价是__________。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________;P、S的第一电离能(I1)的大小为I1(P) __________I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________;乙烯分子中σ键与π键数目之比为__________。
(4)NH3的沸点__________(填“高于”或“低于”)PH3的沸点,原因是____________________。
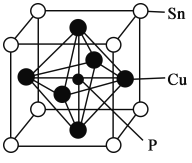
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________nm(用含NA的代数式表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】冬季的降雪给交通带来了诸多不便,其中醋酸钾(CH3COOK)是融雪效果最好的融雪剂,下列关于醋酸钾的说法正确的是( )
A.1 mol CH3COOK的质量为98 g/mol
B.CH3COOH摩尔质量就是它的相对分子质量
C.一个CH3COOH的质量约为60/(6.02×1023)g
D.含有6.02×1023个碳原子的CH3COOH的物质的量是1 mol
-
科目: 来源: 题型:
查看答案和解析>>【题目】烃A与等物质的量的H2O反应生成B,B的一种同系物的溶液可以浸制标本。M是有香味、不易溶于水的油状液体。有关物质的转化关系如下:
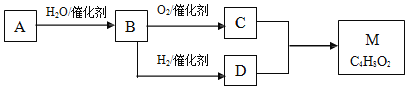
请回答:
(1)写出A的结构简式:______
(2)写出C的官能团的名:______
(3)写出M与NaOH溶液在加热条件下反应的化学反应方程式:______
(4)下列说法不正确的是______
A.烃A在一定条件下可与氯化氢发生反应,再通过加聚反应可得到聚氯乙烯
B.有机物C的溶液可以除去水垢
C.有机物B能与银氨溶液在酒精灯加热的条件下反应产生光亮的银镜
D.有机物C和D发生加成反应生成M
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ、一定温度下,某容器中加入足量的碳酸钙发生反应:CaCO3(s)CaO(s)+CO2(g) △H>0;一段时间后达到平衡。
(1)该反应的化学平衡常数表达式为K=______; 为了提高CO2的生成率,可采取的措施______
A.减压B.升温C.增加碳酸钙的量D.转移出CO2
(2)对于该反应,下列说法正确的是______
A.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S>0
B.将容器缩小为原来的一半,平衡不移动
C.将容器扩大为原来的两倍,平衡发生移动,再次平衡后,气体密度不变
D.增大压强,平衡逆向移动,K值减小
Ⅱ、在恒温恒压密闭容器中通入CO和H2O各1mol发生反应CO(g)+H2O(g)CO2(g)+H2(g),当反应达到平衡后,维持温度与压强不变,t1 时再通入各1 mol的CO 和H2O 的混合气体,请在下图中画出正反应和逆反应速率在t1后随时间t变化的曲线图。
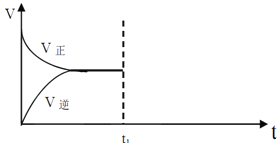 ____________
____________Ⅲ、雾霾的组成成分复杂,包括数百种大气化学颗粒物与气体。图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,阴极的电极反应式是______,物质A是______(填名称)
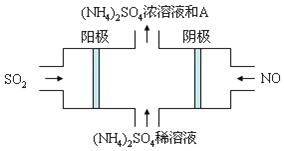
-
科目: 来源: 题型:
查看答案和解析>>【题目】SO2排放至空气中会造成大气污染,某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
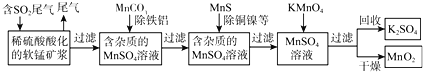
请回答下列问题:
(1)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
根据以上信息写出用MnO2脱硫的热化学方程式是______
(2)第二步加入MnCO3其原因是______
(3)若最后一步所加KMnO4恰好反应完全,如何证明过滤所得的MnO2固体已洗涤干净:______
-
科目: 来源: 题型:
查看答案和解析>>【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
相关试题

