
【题目】下表列出了5种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是_______,⑤的原子结构示意图是__________;
(2)以上元素中,非金属性最强的是___________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈______性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是______(填元素符号);
(5)元素①与元素②的单质氧化性较强的是________(填化学式)。;
(6)元素④的最高价氧化物与元素③的最高价氧化物对应的水化物相互反应的化学方程式__。
【答案】C 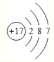 F 两 Na>Mg>Al F2 Al2O3+2NaOH==2NaAlO2+H2O
F 两 Na>Mg>Al F2 Al2O3+2NaOH==2NaAlO2+H2O
【解析】
由元素在元素周期表中的位置可知:①C、②F、③Na、④Al、⑤Cl;
(2)同周期从左到右,随着原子序数增大,非金属性增强;同主族从上到下,非金属性减弱;
(1)①的元素符号是C,⑤是Cl,原子序数是17,其原子结构示意图是: ,故答案为C;
,故答案为C; ;
;
(2)同周期从左到右,随着原子序数增大,非金属性增强;同主族从上到下,非金属性减弱,则以上元素中,非金属性最强的是F,故答案为:F;
(3)④是Al元素,其最高价氧化物对应的水化物是Al(OH)3,即可跟酸反应,又能跟碱反应,呈两性,故答案为:两;
(4)③④⑤分别是Na、Al、Cl,同周期从左到右,随着原子序数增大,原子半径减小,则三种元素的原子半径由大到小的顺序是:Na>Al>Cl,故答案为:Na>Al>Cl;
(5)元素①的单质是C,与元素②的单质是F2,氧化性较强的是F2,故答案为:F2;
(6)元素④的最高价氧化物是Al2O3,元素③的最高价氧化物对应的水化物是NaOH,相互反应的化学方程式:Al2O3+2NaOH==2NaAlO2+H2O,故答案为:Al2O3+2NaOH==2NaAlO2+H2O。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】某化学小组欲利用如图所示的实验装置探究苯与液溴的反应(装置连接顺序为CDAB)
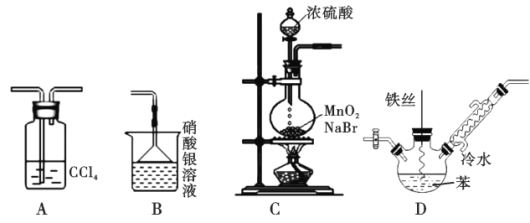
已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是
Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是
A. 装置A的作用是除去HBr中的溴蒸气
B. 装置B的作用是检验HBr
C. 可以用装置C制取溴蒸气
D. 装置D反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)可用于汽车安全气囊的产气药。一种由氨基化钠(NaNH2)制备NaN3的工艺流程如下:
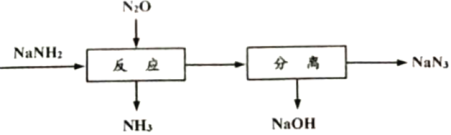
(1)生产NaNH2的化学方程式为2Na+ 2NH3(液)= 2NaNH2+ H2↑。
①钠元素位于周期表第___________周期___________族。
②NaNH2中氮元素的化合价为___________.
(2) NaOH的电子式为___________, 流程中“反应”的化学方程式为___________。
(3) NaN3晶体属于_____________(填 “离子”、“分子”或“原子”)晶体,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:
[Zn(CN)4]2-+4HCHO+4H2O==Zn2++4HOCH2CN+4OH-,回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
(5)Zn与S形成某种化合物的晶胞如图所示。
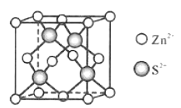
①Zn2+填入S2-组成的___________空隙中;
②已知晶体密度为d g/cm3,该晶胞的边长表达式为______pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是
①甲基的电子式![]() ②Cl-的结构示意图
②Cl-的结构示意图![]() ③苯的结构简式C6H6 ④中子数为20的氯原子
③苯的结构简式C6H6 ④中子数为20的氯原子![]() ⑤乙酸分子的比例模型
⑤乙酸分子的比例模型![]() ⑥H2O2的电子式
⑥H2O2的电子式![]()
A.④B.③④⑤C.④⑤⑥D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
B. C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
C. H2O、NH3、CH4分子中的O、N、C原子均采取sp3杂化
D. 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示:
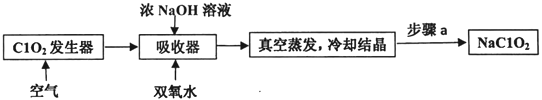
下列说法不正确的是( )
A.步骤a的操作包括过滤、洗涤和干燥
B.通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
C.工业上可将ClO2制成NaClO2固体,便于贮存和运输
D.吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2- -+O2↑+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com