【题目】元素铈(Ce)是一种重要的稀土元素。
(1) 工业上用氟碳铈矿(主要成分为CeFCO3)制备CeO2。焙烧过程中发生的主要反应的化学方程式为________。

(2) 已知CeCl3·7H2O在空气中易被氧化成四价铈,反应如下:
① CeCl3·7H2O(s)=CeCl3(s)+7H2O(g);ΔH1=a kJ·mol-1
② 4CeCl3(s)+O2(g)+14H2O(g)=4Ce(OH)4(s)+12HCl(g);ΔH2=b kJ·mol-1
③ Ce(OH)4(s)=CeO2(s)+2H2O(g);ΔH3=c kJ·mol-1
则4CeCl3·7H2O(s)+O2(g)=4CeO2(s)+12HCl(g)+22H2O(g);ΔH=________。
(3) CeO2是汽车尾气净化催化剂中最重要的助剂,工作原理如图1所示。写出过程1发生反应的化学方程式:________________________________。

(4) 已知Ce(OH)4极易分解,用如图2所示装置电解CeCl3溶液在阴极区制得CeO2。电解过程中反应体系的pH随时间t的变化曲线如图3所示。
①电解进行1h内溶液的pH迅速下降,可能原因是________。
②请解释生成CeO2的原理:________。
(5) 常温下,当溶液中某离子浓度≤1.0×10-5时,可认为该离子沉淀完全。用Na2C2O4溶液对电解后的废液处理得到Ce2(C2O4)3固体,则应保持溶液中c(C2O42-)约为________。(已知25 ℃时,Ksp[Ce2(C2O4)3]=1.0×10-25)
参考答案:
【答案】4CeFCO3+4NaHCO3+O2 ![]() 4NaF+4CeO2+8CO2+2H2O (4a+b+4c) kJ·mol-1 xCO+CeO2=CeO(2-x)+xCO2 产生的Cl2发生反应Cl2+H2OHCl+HClO。由于生成了HCl,使反应体系的pH迅速下降 阳极电解产生的Cl2把Ce3+氧化成Ce4+。同时与阴极电解产生OH-离子反应生成Ce(OH)4,然后再分解生成CeO2[或者Ce3+与阴极电解产生的OH-反应生成Ce(OH)3,Ce(OH)3再被阳极电解产生的Cl2氧化成Ce(OH)4,然后再分解生成CeO2] 1.0×10-5 mol·L-1
4NaF+4CeO2+8CO2+2H2O (4a+b+4c) kJ·mol-1 xCO+CeO2=CeO(2-x)+xCO2 产生的Cl2发生反应Cl2+H2OHCl+HClO。由于生成了HCl,使反应体系的pH迅速下降 阳极电解产生的Cl2把Ce3+氧化成Ce4+。同时与阴极电解产生OH-离子反应生成Ce(OH)4,然后再分解生成CeO2[或者Ce3+与阴极电解产生的OH-反应生成Ce(OH)3,Ce(OH)3再被阳极电解产生的Cl2氧化成Ce(OH)4,然后再分解生成CeO2] 1.0×10-5 mol·L-1
【解析】
(1)焙烧过程中,CeFCO3和加入的NaHCO3反应转化生成CeO2和二氧化碳,焙烧过程O2参加反应,根据物料守恒和得失电子守恒写出主要反应的方程式;
(2)利用盖斯定律,分析计算目标反应焓变;
(3)过程1中,CeO2和一氧化碳反应生成二氧化碳CeO(2-x),据此书写方程式;
(4)根据电解过程中阴阳极电极上的产物分析;
(5)利用溶度积常数计算公式进行计算。
(1)焙烧过程中,CeFCO3和加入的NaHCO3反应转化生成CeO2和二氧化碳,焙烧过程O2参加反应,根据物料守恒和得失电子守恒,主要反应的方程式为:4CeFCO3+4NaHCO3+O2 ![]() 4NaF+4CeO2+8CO2+2H2O;
4NaF+4CeO2+8CO2+2H2O;
(2)已知:①CeCl3·7H2O(s)=CeCl3(s)+7H2O(g);ΔH1=a kJ·mol-1
②4CeCl3(s)+O2(g)+14H2O(g)=4Ce(OH)4(s)+12HCl(g);ΔH2=b kJ·mol-1
③Ce(OH)4(s)=CeO2(s)+2H2O(g);ΔH3=c kJ·mol-1
则根据盖斯定律:①×4+②+③×4,可得4CeCl3·7H2O(s)+O2(g)=4CeO2(s)+12HCl(g)+22H2O(g);ΔH=(4a+b+4c) kJ·mol-1;
(3)根据图1所示,过程1中CeO2和一氧化碳反应生成二氧化碳CeO(2-x),根据物料守恒,化学反应方程式为:xCO+CeO2=CeO(2-x)+xCO2;
(4) ①如图2所示装置,电解CeCl3溶液,阳极上电解质溶液中氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2,产生的Cl2与电解液中的水反应生成盐酸和次氯酸,反应方程式为:Cl2+H2OHCl+HClO,使电解质溶液酸性增强,pH减小;
②电解CeCl3溶液在阴极区制得CeO2,电解过程中,Ce的化合价升高,被氧化,结合(4)中分析,阳极电解产生的Cl2把Ce3+氧化成Ce4+。同时与阴极电解产生OH-离子反应生成Ce(OH)4,结合已知信息,Ce(OH)4极易分解,生成CeO2[或者Ce3+与阴极电解产生的OH-反应生成Ce(OH)3,Ce(OH)3再被阳极电解产生的Cl2氧化成Ce(OH)4,然后再分解生成CeO2];
(5) 当溶液中某离子浓度≤1.0×10-5时,可认为该离子沉淀完全,则Ce3+完全沉淀时,溶液中c(Ce3+)= 1.0×10-5mol/L,Ksp[Ce2(C2O4)3]=c2(Ce3+) c3(C2O42-)=1.0×10-25,则c(C2O42-)=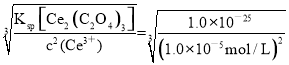 = 1.0×10-5 mol·L-1。
= 1.0×10-5 mol·L-1。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是

A.该电池放电时的正极反应为2Li-2e-+CO32-===Li2CO2
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-===3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的组合是
A.SiO2(s)
 SiCl4(g)
SiCl4(g)  Si(s)
Si(s)B.Fe3O4(s)
 Fe(s)
Fe(s)  FeCl2(s)
FeCl2(s)C.AgNO3(aq)
 [Ag(NH3)2]+
[Ag(NH3)2]+ Ag(s)
Ag(s)D.Al2O3(s)
 NaAlO2(aq)
NaAlO2(aq)  Al(OH)3(s)
Al(OH)3(s) -
科目: 来源: 题型:
查看答案和解析>>【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液:Na+、Ba2+、NO3-、OH-
B.0.1 mol·L-1NaAlO2溶液:K+、OH-、Cl-、NO3-
C.常温下,
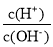 =1.0×1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1.0×1012的溶液:Fe2+、Mg2+、NO3-、Cl-D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO32-、S2-、Cl-
-
科目: 来源: 题型:
查看答案和解析>>【题目】NOx、SO2的处理转化对环境保护有着重要意义。
(1) 利用反应2NO(g)+2CO(g) N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=
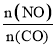 ]的关系如图1所示。
]的关系如图1所示。
①该反应的ΔH________(填“>”“<”或“=”)0。
②下列说法正确的是________(填字母)。
A. 当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B. 投料比:m1>m2>m3
C. 当投料比m=2时,NO转化率是CO转化率的2倍
D. 汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为________。
(2) 若反应2NO(g)+2CO(g) N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1 L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时v正∶v逆=________。
(3) 工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图3为298 K各气体分压(气体的物质的量分数与总压的乘积)与CO物质的量分数
 的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。
的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。
下列说法正确的是________(填字母)。
A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种
B.温度越高脱硫脱硝的效果越好
C.NOx比SO2更易被CO还原
D.体系中可能发生反应:2COSS2+2CO;4CO2+S24CO+2SO2
(4) NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝除技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图5所示,则总反应方程式为________。

(5) 用间接电化学法去除烟气中NO的原理如图6所示,则阴极的电极反应式为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
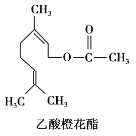
①属于芳香族化合物 ②不能发生银镜反应
③分子式为C12H20O2 ④它的同分异构体中可能有酚类
⑤1 mol该有机物水解时只能消耗1molNaOH
A. ②③④B. ②③⑤C. ①②③D. ①④⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。
以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
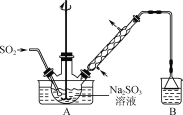
步骤1:在右图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1) 装置B的烧杯中应加入的溶液是________。
(2) 步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:________。
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是________。
(3) 冷凝管中回流的主要物质除H2O外,还有________(填化学式)。
(4) 步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是________。
(5) 步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,________________________________________________________,900 ℃煅烧。 (已知:① Zn能与NaOH发生反应Zn+2NaOH===Na2ZnO2+H2↑;② Zn2+开始沉淀的pH为5.9,沉淀完全的pH为8.9,pH>11时,Zn(OH)2能生成ZnO22-。实验中须使用的试剂有1.0 mol·L-1 NaOH溶液、1.0 mol·L-1 HCl溶液、水)
相关试题

