【题目】室温下,用等浓度的NaOH溶液,分别滴定浓度均为0.1 mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
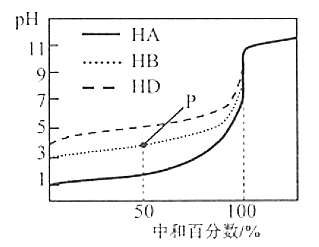
A.等浓度的三种酸中和等量的NaOH需要三种酸的体积:V(HA)>V(HB)>V(HD)
B.从滴定开始至pH=7时,三种溶液中水的电离程度逐渐增大
C.滴定至P点时,溶液中:c(HB)+c(H+)=c(B-)+c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
【答案】B
【解析】
A.三种酸都是一元酸,与碱中和能力相同。中和等物质的量的NaOH,消耗三种酸的物质的量也相等,根据n=c![]() V,若三种酸的浓度相等,则消耗三种酸的体积也相等,故中和等量的NaOH需要三种酸的体积关系为:V(HA)=V(HB)=V(HD),A错误;
V,若三种酸的浓度相等,则消耗三种酸的体积也相等,故中和等量的NaOH需要三种酸的体积关系为:V(HA)=V(HB)=V(HD),A错误;
B.向三种酸溶液中逐滴加入NaOH溶液,溶液的酸性逐渐减弱,酸对水电离的抑制作用逐渐减弱,水电离程度逐渐增大,当酸恰好被中和产生盐时,水电离程度达到最大。在溶液pH=7时,三种酸还没有完全被中和,因此水电离程度逐渐增大,B正确;
C.根据电荷守恒可得①:c(Na+)+c(H+)=c(OH-)+c(B-),P点时根据横坐标中和百分数为50%,可知c(NaB):c(HB)=1:1,此时的溶液显酸性,c(H+)>c(OH-),则c(B-)>c(HB),根据物料守恒可得②:2c(Na+)=c(B-)+c(HB),①×2-②整理可得c(HB)+2c(H+)=c(B-)+2c(OH-),由于c(H+)>c(OH-),所以c(HB)+c(H+)<c(B-)+c(OH-),C错误;
D.根据图示可知:0.1 mol/L的酸HA的pH=1,c(H+)=0.1 mol/L=c(HA),说明HA是一元强酸,中和百分数达到100%,混合溶液中c(NaA)=c(NaB)=c(NaD),NaA是强酸强碱盐,不水解;而HB、HD中c(H+)小于酸的浓度,证明HB、HD是弱酸,在溶液中盐NaB、NaD水解使溶液显碱性,根据质子守恒可得:c(OH-)=c(HB)+c(HD)+c(H+),所以c(HB)+c(HD)=c(OH-)-c(H+),所以c(HA)+c(HB)+c(HD)>c(OH-)-c(H+),D错误;
故合理选项是B。

