
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
【答案】BD
【解析】
三个容器中,Ⅰ与Ⅱ均为恒容容器,差别在于前者恒温,后者绝热;不妨设想容器Ⅳ,其与容器Ⅰ其余的条件相同,仅投料方式按照容器Ⅱ中的投料方式进行,那么容器Ⅳ中的平衡与Ⅰ中的等效,容器Ⅳ中的反应达到平衡时,Cl2的物质的量为1mol。容器Ⅲ相比于容器Ⅰ,体积扩大了一倍,初始投料也增加了一倍,但容器Ⅲ是在恒温恒压的条件下反应的;不妨设想容器Ⅴ,其与容器Ⅲ的其他的条件相同,仅容器类型更改为恒温恒容的容器,那么容器Ⅴ中的平衡状态与Ⅰ中的等效,容器Ⅴ中的反应达到平衡时,Cl2的物质的量为2mol。
A.4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,反应4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l),生成液态水,气态水变液态水放出热量,因此ΔH<-116 kJ·mol-1,故A错误;
2Cl2(g)+2H2O(l),生成液态水,气态水变液态水放出热量,因此ΔH<-116 kJ·mol-1,故A错误;
B.构造的容器Ⅳ的类型是恒温恒容,容器Ⅱ的类型是绝热恒容,二者都是逆向反应建立的平衡状态,容器Ⅱ由于是绝热的,所以容器Ⅱ中的温度会越来越低,不利于反应逆向进行,相比于容器Ⅳ达到平衡时消耗的Cl2更少,所以a>1;构造的容器Ⅴ的类型为恒温恒容,容器Ⅲ的类型为恒温恒压,二者都是正向反应建立的平衡,由于容器Ⅴ为恒容容器,所以反应开始后容器Ⅴ中的压强逐渐小于容器Ⅲ中的压强,压强越小越不利于反应正向进行,因此平衡时,容器Ⅴ中的Cl2的量小于容器Ⅲ中的,所以b>2,故B正确;
C.根据阿伏加德罗定律PV=nRT可知,温度相同,体积相同,则压强之比等于物质的量之比![]() ,解得p2=1.6×105Pa,III容器体积和加入的物质的量都是I容器的2倍,因此压强相同p3=2×105Pa,故C错误;
,解得p2=1.6×105Pa,III容器体积和加入的物质的量都是I容器的2倍,因此压强相同p3=2×105Pa,故C错误;
D.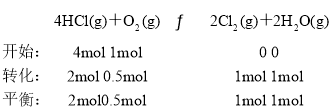 ,反应容器Ⅰ平衡常数
,反应容器Ⅰ平衡常数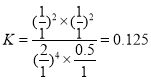 ,若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,
,若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,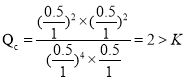 ,则反应向逆反应方向进行,故D正确。
,则反应向逆反应方向进行,故D正确。
综上所述,答案为BD。


科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
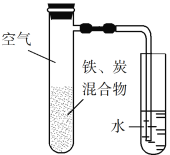
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学探究在实验室中![]() 检验的干扰因素。
检验的干扰因素。
(1)检验溶液中是否含有![]() 时先用过量盐酸将溶液酸化,其目的是排除_______________、
时先用过量盐酸将溶液酸化,其目的是排除_______________、![]() 、Ag+等离子可能造成的干扰。
、Ag+等离子可能造成的干扰。
(2)为了验证盐酸能否排除![]() 的干扰,该小组同学进行了如下实验:
的干扰,该小组同学进行了如下实验:
Ⅰ.量取一定体积的浓盐酸(盛放浓盐酸试剂瓶的标签中部分信息如下图),稀释,配制成 5 mol/L 的稀盐酸。

Ⅱ.甲同学取 0.3 g 未变质的 Na2SO3 固体,向其中加入上述 5mol/L 稀盐酸至过量,产生大量气泡。充分振荡后滴加 4 滴BaCl2 溶液,迅速产生白色浑浊,产生白色浑浊的原因可能是:
①______________。
②盐酸中含有 Fe3+,实验证实含有 Fe3+的方案是:___________________,用离子方程式解释由 Fe3+产生白色浑浊的原因:__________。
(3)乙同学提出,检验![]() 时能否用硝酸酸化来排除
时能否用硝酸酸化来排除![]() 的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
硝酸浓度(mol/L) | 滴加氯化钡溶液之前现象 | 滴加氯化钡溶液之后现象 |
15.0(浓硝酸) | 产生大量红棕色气体,溶液呈黄色 | 立即产生大量白色沉淀 |
7.5 | 产生大量红棕色气体,溶液呈淡黄色 | 立即产生大量白色沉淀 |
4.8 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 60 min 后溶液开始变浑浊 |
2.0 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 70 min 后溶液开始变浑浊 |
0.5 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 120 min 后溶液开始变浑浊 |
依据上述实验得出的结论是:________________。
(4)丙同学查阅资料后提出:Cl-的存在也会对![]() 的检验产生干扰。在 Cl-催化作用下,稀硝酸可将
的检验产生干扰。在 Cl-催化作用下,稀硝酸可将![]() 氧化为
氧化为 ![]() 。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
实验 | 实验操作 | 实验现象 |
ⅰ | 将 0.3 g Na2SO3 和 0.3 g NaCl 固体混合,加入 10 mL 2.0mol/L 的稀硝酸,振荡后,再滴加 4 滴 BaCl2 溶液。 | 立即产生大量白色沉淀。 |
ⅱ | ____________。 | 放置两小时后溶液未变浑浊。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平衡常数:K(a)>K(c)、K(b)>K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的“食品、矿产、能源、药物和水产资源”等,下列说法正确的是

A.第①步中除去泥沙及Ca2+、Mg2+等杂质时,不涉及化学变化过程
B.工业上,通过电解“精盐”水溶液可以制取金属钠
C.第②步的反应条件是“在空气中直接加热”
D.第③、④、⑤步中均涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
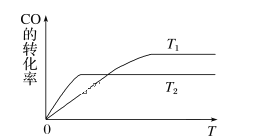
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
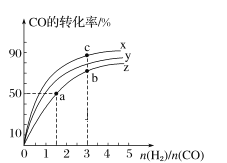
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2019 年第十届国际二次电池展中,一种以 Fe[Fe(CN)6]为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是
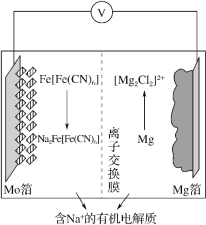
A.充电时,阴极反应式为 Fe[Fe(CN)6 ]+2Na++2e- =Na2Fe[Fe(CN)6 ]
B.充电时,Mg 箔接电源的正极
C.放电时,Na+通过离子交换膜从右室移向左室
D.放电时,外电路中通过 0.4mol 电子时,负极质量变化为 9.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风-41 核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)查阅资料显示第二电离能 Cu 大于 Zn,理由是 _____________。
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为______,S的_____杂化轨道与O的2p轨道形成______键(填“π”或“σ”)。
(3)铁元素能与 CO 形成 Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为____。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为__(填字母序号)。
A. B.
B.  C.
C.  D .
D .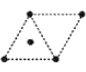
a. 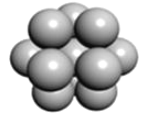 b.
b.  c.
c. 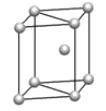
(5) 镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__;晶胞是图中的_(填 a、b 或 c);配位数是___;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,则镁的摩尔质量的计算式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
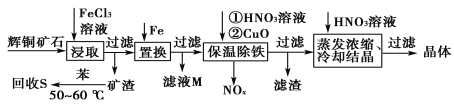
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
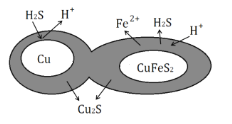
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com